
【题目】研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g)△H=+180.50kJmol-1
2NO(g)△H=+180.50kJmol-1
2CO(g)+O2(g)![]() CO2(g)△H=-566.00kJmol-1
CO2(g)△H=-566.00kJmol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参 与大气循环.写出该反应的热化学方程式___________________________;
(2)T℃时,将等物质的量的NO和CO充人容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如下图所示.
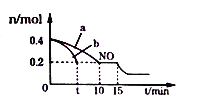
①T℃时该化学反应的平衡常数K=____________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将__________移动;(填“向左”、“向右”或“不”)
②图1中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是_______(填“a”或“b”)
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____________;
(二)SO2主要来源于煤的燃烧.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关健。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是________________;
(4)如图所示的电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-。
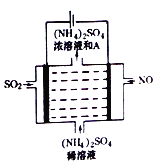
①写出物质A的化学式_________,阳极的电极反应式是________________;
②该电解反应的化学方程式为________________。
【答案】(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.50 kJmol-1
2CO2(g)+N2(g)△H=-746.50 kJmol-1
(2)①5(mol/L)-1 向右 ②b ③增加CO的物质的量浓度或增大压强
(3)H2O+2SO2+CO32-═2HSO3-+CO2↑ (4)① H2SO4 SO2+2H2O-2 e-═SO42-+4H+
②5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4
(NH4)2SO4+4H2SO4
【解析】
试题分析:(1)已知:N2(g)+O2(g)![]() 2NO(g)△H=+180.50kJmol-1①
2NO(g)△H=+180.50kJmol-1①
2CO(g)+O2(g)![]() CO2(g)△H=-566.00kJmol-1②
CO2(g)△H=-566.00kJmol-1②
根据盖斯定律:②-①得到:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.50 kJmol-1;
2CO2(g)+N2(g)△H=-746.50 kJmol-1;
(2)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO(g)+2CO(g)![]() 2CO2(g)+N2
2CO2(g)+N2
起始物质的量:0.4mol 0.4mol 0 0
转化的物质量:0.2mol 0.2mol 0.2mol 0.1mol
平衡物质的量:0.2mol 0.2mol 0.2mol 0.1mol
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
k=![]() =5(mol/L)-1;
=5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=![]() =1.8<k,则平衡将向右移动;
=1.8<k,则平衡将向右移动;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;故答案为b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
(3)碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(4)电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4,
(NH4)2SO4+4H2SO4,
①由电解方程式可知,物质A为硫酸,其的化学式H2SO4; 电解时,阳极上二氧化硫失电子生成硫酸根离子,则阳极的电极反应式是SO2+2H2O-2 e-═SO42-+4H+;
②电解时NO、SO2分别转化为NH4+和SO42-,结合原子守恒可知电解方程式为:5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4。
(NH4)2SO4+4H2SO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
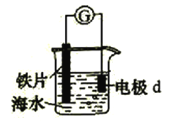
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+ 2H2O + 4e = 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++ 2e = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是

(1)和金属钠作用时,断裂______
(2)和浓硫酸共热至170 ℃时,断裂______
(3)和乙酸、浓硫酸共热时,断裂_______
(4)在铜催化下和氧气反应时,断裂_____
(5)与氢卤酸反应时,断裂______
查看答案和解析>>
科目:高中化学 来源: 题型:
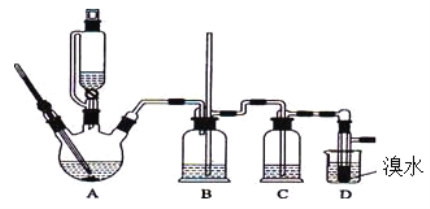
【题目】)实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 。
(2)装置B的作用是__________________________。
(3)在装置C中应加入 (填字母)。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 (填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是
。
(7)判断该制备反应已经结束的最简单方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:


请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面 。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(2)为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃ ,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 ; 。
(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。

已知:![]()
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为_______ ,
B与银氨溶液反应的化学方程式是________________________________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是______________________。
(5)满足以下条件的F的同分异构体(含F)共有________(填数字)种。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有![]() 结构
结构
③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号)。

(1)芳香烃:_____________ ;(2)卤代烃:_____________;(3)醇:_______________ ;
(4)酚:_____________;(5)醛:_______________ ;(6)酮:_____________;
(7)羧酸:_____________ ;(8)酯:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大学实验室对煤矸石(主要含Al2O3、SiO2及Fe2O3)制备聚合氯化铝{[Al2(OH)nCl6-n]m(1≤n≤5,m≤10),简称PAC,是一种新型、高效的絮凝剂和净水剂}。其工艺流程如下:

请回答下列问题:
(1)用浓盐酸配制20%的盐酸所需的玻璃仪器有______________________________。
(2)加20%的盐酸酸浸,有关反应的离子方程式为_____________________________。
(3)残渣2的主要成分是,设计实验证明你的结论(填操作、现象):_____________________。
(4)由澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是_________________,得到的PAC粗产品中可能含有的杂质离子是____________。
(5)从不引入杂质的角度来考虑,调节溶液pH的试剂可改为________(填字母)。
A.NaOH B.Al C.氨水 D.Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com