
 的质量分数,在实验室中按以下步骤进行实验:
的质量分数,在实验室中按以下步骤进行实验:| 112 |
| 160 |
| 112 |
| 160 |
| 250 |
| 25 |
| 7(W2-W1)g |
| ag |
| 7(W2-W1)g |
| ag |
| 7(W2-W1)g |
| ag |


科目:高中化学 来源: 题型:
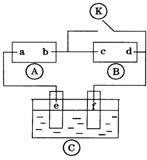 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A、a为直流电源的负极 |
| B、d极发生的反应为2H++2e-=H2↑ |
| C、f电极为铜板 |
| D、e极发生的反应为Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离是放热过程 |
| B、放热反应的反应速率是大于吸热反应的反应速率 |
| C、生成物总能量一定低于反应物的总能量 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
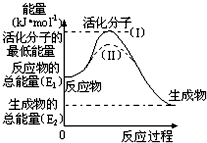 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示.请认真观察图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na2CO3溶液中各离子浓度大小关系一定有c(Na+)>c(
| ||
| B、25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Kxp大小顺序为盐酸>氯化铵>蒸馏水 | ||
| C、已知25℃时NH4F显酸性,则25℃时的电离常数K(NH3?H2O)<K(HF) | ||
| D、AlCl3溶液和Al2(SO4)3溶液加热蒸干、灼烧都得到Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、④⑤ |
| C、③④⑤⑥ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将碘水倒入分液漏斗,加适量四氯化碳,振荡后静置,可将碘萃取到下层液体中 |
| B、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| C、加入盐酸以除去硫酸钠中的少量碳酸钠杂质 |
| D、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,会得到含氢氧化铁的FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com