
【题目】Ⅰ.常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)这四种溶液中水的电离程度由大到小的顺序是___________________(用序号填写)。
(2)等体积混合③和④的溶液中离子浓度的大小顺序是:__________________________。
(3)②溶液中存在的质子守恒关系:c(OH-)=___________________________。
(4)向④中加入少量氯化铵固体,溶液中c(H+)______(填“增大”、“减小”或“不变”)
(5)取10mL溶液③,加水稀释到100mL,则该溶液中由水电离出的c(H+)约为________。
Ⅱ.普通泡沫灭火器内的玻璃筒里盛有Al2(SO4)3溶液,铁筒中盛有NaHCO3溶液,当意外失火时,打开泡沫灭火器使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为:______________________________________,不能把Al2(SO4)3溶液盛放在铁筒中的主要原因是______________________________________________________。
Ⅲ.某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是___________________,调pH的最适宜范围为__________。
(2)调pH过程中加入的试剂最好是___________(填标号)。
A. NaOH B. CuO C.NH3·H2O D.HCl
【答案】①>②>④>③ c (Cl-)>C(NH4+) >c (H+)>c (OH﹣) c(OH-)=c(H+)+c(H2CO3)-c(CO32-) 增大 10-12 mol/L 3HCO3-+ Al3+== Al(OH)3↓+ 3CO2↑ 因Al3+发生水解:Al3++3H2O ![]() Al(OH)3+3H+,溶液呈酸性会腐蚀铁筒 将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离 3.2-4.4 B
Al(OH)3+3H+,溶液呈酸性会腐蚀铁筒 将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离 3.2-4.4 B
【解析】
Ⅰ.(1)水解的盐促进水的电离,酸碱抑制水的 电离,盐水解程度越大,水的电离平衡程度越大,弱酸碱抑制水电离程度小于强酸强碱;
(2)等体积混合③和④的溶液溶质为氯化铵,铵根离子水解显酸性;
(3)NaHCO3溶液中,根据质子守恒规律作答;
(4)NH3·H2O电离生成铵根离子与氢氧根离子,加入氯化铵后抑制一水合氨的电离;
(5)根据稀释后溶质HCl的氰离子浓度和水的离子积常数Kw计算分析,由水电离的氢氧根离子浓度等于由水电离出的c(H+),从而得出结论;
Ⅱ.碳酸氢钠水解导致溶液呈碱性;,硫酸铝水解导致其溶液呈酸性,碳酸氢钠和硫酸铝在水溶液中能相互促进水解生成二氧化碳和氢氧化铝,写出相应的离子方程式,注意碳酸氢根离子不能写成碳酸根离子和氢离子;
Ⅲ.电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物,双氧水具有强氧化性,可氧化还原性的物质Fe2+,使其转化为Fe3+,根据表中数据可以看出,其目的是调整合理的pH范围,便于Fe(OH)3沉淀与Cu2+分离开,调整pH值时,加入的试剂目的是除去溶液中的酸且不引入其他杂质,据此分析作答;
Ⅰ.(1)①Na2CO3②NaHCO3盐溶液中阴离子水解促进水的电离,其水的电离程度增大,,碳酸根离子水解程度大于碳酸氢根离子,则水的电离程度①>②,而③HCl④NH3H2O是酸和碱,抑制水的电离,一水合氨为弱碱,对水抑制作用相对较小,水电离程度④>③,则四种溶液中水的电离程度由大到小的顺序是①②④③,
故答案为:①②④③;
(2)等体积混合③HCl④NH3H2O,生成氯化铵溶液,溶液中铵根离子发生水解,其方程式为:NH4+ + H2O![]() NH3·H2O+ H+,根据电荷守恒可知,其离子浓度大小为:c (Cl-)>C(NH4+) >c (H+)>c (OH﹣),
NH3·H2O+ H+,根据电荷守恒可知,其离子浓度大小为:c (Cl-)>C(NH4+) >c (H+)>c (OH﹣),
故答案为:c (Cl-)>C(NH4+) >c (H+)>c (OH﹣);
(3)②NaHCO3溶液遵循质子守恒规律,即c(OH-)=c(H+)+c(H2CO3)-c(CO32-),
故答案为:c(OH-)=c(H+)+c(H2CO3)-c(CO32-);
(4)④NH3·H2O中存在电离平衡,为弱碱,当加入氯化铵固体时,由于铵根离子浓度增大,抑制其电离平衡,故溶液中的c(OH-)降低,根据水的离子积KW=c(H+)×c(OH)保持不变可知,c(H+)增大;
(5)0.1 mol/L的HCl溶液10mL加水稀释到100mL,其氰离子浓度c(H+) = 0.01 mol/L,根据水的离子积KW=c(H+)×c(OH)可知,常温下溶液中由水电离的氢氧根离子浓度c(OH) = ![]() =
= ![]() = 10-12 mol/L,则该溶液中由水电离出的c(H+)约为10-12 mol/L,
= 10-12 mol/L,则该溶液中由水电离出的c(H+)约为10-12 mol/L,
故答案为:10-12 mol/L;
Ⅱ.碳酸氢钠是强碱弱酸盐,碳酸氢根离子能水解使溶液中氢氧根离子浓度大于氢离子浓度而导致其溶液呈碱性,水解离子方程式为:HCO3-+H2OH2CO3+OH-;硫酸铝是强酸弱碱盐能水解,其水解方程式为:Al3++3H2O Al(OH)3+3H+,碳酸氢钠的水溶液呈碱性,两者在水溶液中能相互促进水解生成二氧化碳和氢氧化铝,离子方程式为:3HCO3-+Al3+= Al(OH)3↓+3CO2↑;铁的金属活动性顺序比铝弱,但不把Al2(SO4)3溶液盛放在铁筒中,其主要原因也是因为铝离子水解显酸性,腐蚀铁筒,
故答案为: 3HCO3-+Al3+=Al(OH)3↓+3CO2↑;因Al3+发生水解:Al3++3H2O ![]() Al(OH)3+3H+,溶液呈酸性会腐蚀铁筒;
Al(OH)3+3H+,溶液呈酸性会腐蚀铁筒;
Ⅲ.(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物,双氧水具有强氧化性,可氧化还原性的物质Fe2+,使其转化为Fe3+,,便于Fe(OH)3沉淀与Cu2+分离开;根据表中数据可以看出,Fe(OH)3完全沉淀时pH = 3.2,Cu(OH)2开始沉淀时pH = 4.4,为使Fe3+完全沉淀,而与Cu2+分离开来,调整的pH范围应为3.2-4.4,
故答案为:将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离;3.2-4.4;
(2)调整pH值时,加入的试剂目的是除去溶液中的酸且不引入其他杂质,故pH过程中加入的试剂最好是氧化铜、氢氧化铜或碳酸铜,故B项正确,而氢氧化钠和氨水会引入新的杂质阳离子钠离子与铵根离子,故A、C项错误,盐酸达不到除杂的目的,故D项错误,
答案选B;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法” 又叫“联合制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱Na2CO3,有关反应的化学方程式:
(1)______________。
(2)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为_____。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是__________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,、记录C的液面位置;
④由A向B中滴加足量试剂,上述操作的顺序是______(填序号);
记录C的液面位置时,除平视和恢复至室温外,还应___________。
(4)B中发生反应的化学方程式为__________________。
(5)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况,B中剩余固体的质量为cg,则铝的相对原子质量为________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将_____(填“偏大”“偏小”或“不受影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如下图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法正确的是

A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
D. b极的电极反应式为:MnO2+2H2O+2e-=Mn2++4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为_________________,其最外层电子的电子云形状为___________。
(2)(NH4)2Fe(SO4)26H2O俗称摩尔盐。
①O、S两元素的电负性由大到小的顺序为_____________(用元素符号表示)。
②N、O两元素的的第一电离能由大到小的顺序为___________(用元素符号表示)。
③SO42-中S原子的杂化方式为___________,VSEPR模型名称为___________________。
(3)Fe3+可与某阴离子发生特征的显色反应,用于鉴定Fe3+。该阴离子的电子式为_____,σ键和π键的数目之比为______________。其空间构型为__________。
(4)K3[Fe(CN)6]晶体中配离子的配位体为_____(用化学符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx。下列说法不正确的是

A. 负极反应式为Na - e- = Na+
B. 放电时,消耗32 g正极活性物质,转移的电子为2 mol
C. M的作用是导电和隔离钠与硫
D. 消耗相同质量的负极活性物质,钠硫电池的理论放电量是铅蓄电池的4.5倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)![]() H2O(l) 的ΔH =" 40.69" kJ·mol-1
H2O(l) 的ΔH =" 40.69" kJ·mol-1
B. 已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6
C. 已知:![]() 则可以计算出反应
则可以计算出反应 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
D. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S ![]() TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S* → TiO2/S++e-
I![]() +2e-→ 3I-
+2e-→ 3I-
2TiO2/S++3I-→ 2TiO2/S+I3-
下列关于该电池叙述不正确的是
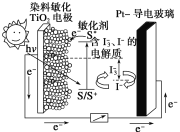
A. 电池工作时,I-在镀铂导电玻璃电极上放电
B. 电池工作时,是将太阳能转化为电能
C. 电池的电解质溶液中I-和I![]() 的浓度不会减少
的浓度不会减少
D. 电池中镀铂导电玻璃为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com