
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
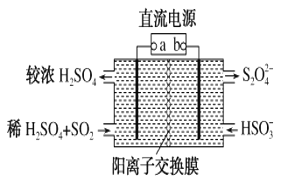
A. a为直流电源的负极
B. 阴极的电极反应式为2HSO3-+2H++e-=S2O42-+2H2O
C. 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是( )
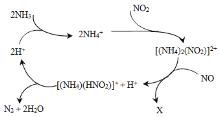
A.X是N2
B.汽车尾气中含有的氮氧化合物是由于汽油燃烧产生的
C.NH4+中含有非极性共价键
D.上述历程的总反应为:2NH3+NO +NO2 2N2+3H2O
2N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________。
(2)A与F形成离子化物FA的电子式为___________。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________。16g该物质反应转移的电子数目为________。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________(简要说明原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用勒夏特列原理解释的是
A. 加入催化剂有利于氨的合成
B. 煅烧粉碎的黄铁矿矿石有利于SO2的生成
C. 硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5molCH4含_________个电子。
(2)下列物质既能导电,又属于电解质的是_______ 。
A NaCl溶液 B铁丝 C稀硫酸 D熔融的氢氧化钠 E 盐酸 F 硫酸
(3)同温同压下,甲容器中HCl气体和乙容器中的NH3所含原子个数相等,则甲乙两容器的体积之比为________。
(4)现配制500ml 0.3mol/L稀硫酸溶液,需用量筒量取质量分数为49%,密度为1.5g/cm3的浓硫酸 _________ml。
(5)①20℃、101kPa下,1g氢气和14g氮气的体积相同;
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L;
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA。
以上说法正确的是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是( )
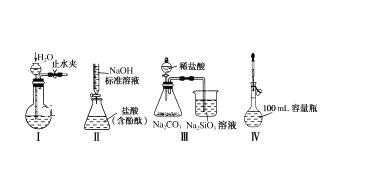
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
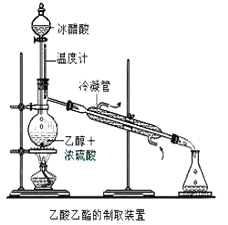
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
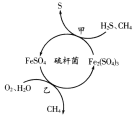
A.过程甲中发生反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B.脱硫过程O2间接氧化H2S
C.该脱硫过程需要不断添加Fe2(SO4)3溶液
D.过程乙发生反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com