
【题目】天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
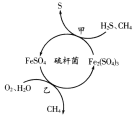
A.过程甲中发生反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B.脱硫过程O2间接氧化H2S
C.该脱硫过程需要不断添加Fe2(SO4)3溶液
D.过程乙发生反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
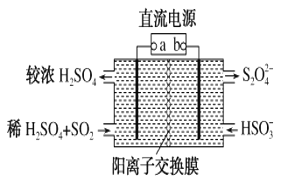
A. a为直流电源的负极
B. 阴极的电极反应式为2HSO3-+2H++e-=S2O42-+2H2O
C. 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题:
(1)属于混合物的是__________ (填序号,下同),属于电解质的是__________ 。
(2)上述物质中__________与__________在水溶液中可发生反应,且离子方程式为H++OH-=H2O。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________,反应的离子方程式为__________;证明有Fe(OH)3胶体生成的实验操作及现象是__________
(4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为__________g,从配制好的溶液中取出300mL,其中含有SO42-的数目为__________(设
NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一定体积的容器中发生反应:A(s)+3B(g)![]() 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是( )
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是( )
①A的质量不发生变化 ②单位时间内生成a mol A,同时消耗2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤n(A):n(B):n(C):n(D)=1:3:2:2 ⑥B的浓度不变
A. ①③⑤⑥B. ①③④⑥C. ②④⑤D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了提纯氯化钠固体(混有硫酸钠、碳酸铵杂质),设计了如下实验方案,请回答:
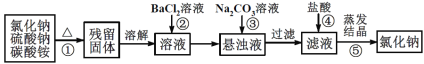
(1)操作①在加热时盛装混合物的仪器可选择__________。
(2)操作②若改为加硝酸钡溶液,对本实验的影响是__________。
(3)进行操作②后,判断SO42-已除尽的方法是__________。
(4)操作③的目的是_____________。
(5)操作⑤蒸发结晶的具体操作为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠可用作碘的助溶剂,是制备碘化物的原料。化学实验小组用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。
已知:①水合肼(N2H4·H2O)的沸点118℃,100℃开始分解;具有强还原性。②I-、IO3-在碱性条件下共存,酸性条件下反应生成I2。化学实验小组用下图所示装置制备碘化钠,实验步骤如下:
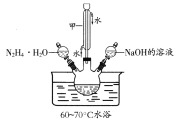
Ⅰ.制备水合肼:用:NaC1O氧化NH3制得水合肼,并将所得溶液装入上述装置左侧分液漏斗。
Ⅱ.向三颈烧瓶中加入一定量单质碘,打开右侧分液漏斗活塞,加入足量NaOH溶液,保持60~70℃水浴,充分反应得到NaI和NaIO3的混合溶液。
Ⅲ.打开左侧分液漏斗活塞,将水合肼溶液加入三颈瓶,并保持60~70℃水浴至反应充分。
Ⅳ.向Ⅲ所得溶液中加入适量活性炭,煮沸半小时,过滤,从滤液中分离出产品。
回答下列问题:
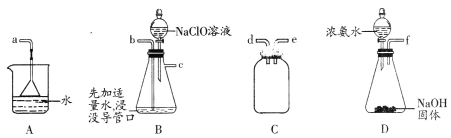
(1)仪器甲的名称是________________。
(2)用下图所示装置制备水合肼:
①仪器的接口依次连接的合理顺序是________________________(用字母表示)。
②实验过程中,需要缓慢滴加NaC1O溶液的主要原因是____________________________。
(3)步骤Ⅲ中温度保持在70℃以下的原因是_______________________________________。
(4)步骤Ⅳ中分离出产品的操作是_____________________、洗涤、干燥。
(5)设计方案检验步骤Ⅲ所得溶液中含有NaIO3:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CH4的质量是_____________,在标准状况下的体积为____________;含电子的物质的量是_____________。
(2)同温同压下,等质量的O2和CO2 ,物质的量之比为______________,原子个数比为_____________,密度比为_______________。
(3)下列数量的各物质所含原子数按由大到小的顺序排列是____________________。
①0.5 mol氨气 ②标准状况下22.4 L氦气
③4 ℃时9 mL水 ④0.2 mol磷酸钠(Na3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
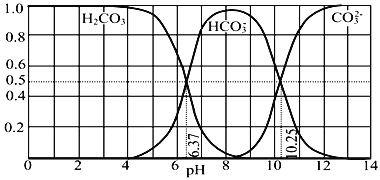
A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com