
【题目】已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题:
(1)属于混合物的是__________ (填序号,下同),属于电解质的是__________ 。
(2)上述物质中__________与__________在水溶液中可发生反应,且离子方程式为H++OH-=H2O。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________,反应的离子方程式为__________;证明有Fe(OH)3胶体生成的实验操作及现象是__________
(4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为__________g,从配制好的溶液中取出300mL,其中含有SO42-的数目为__________(设
NA为阿伏加德罗常数的值)。
【答案】②⑦⑧ ①④⑤⑥⑨⑩ ⑥ ⑨ ①⑦ Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ 用激光笔照射,侧面若有一条明亮的光路,则证明有胶体生成 25.0 0.03NA
Fe(OH)3(胶体)+3H+ 用激光笔照射,侧面若有一条明亮的光路,则证明有胶体生成 25.0 0.03NA
【解析】
(1)①H2O是纯净物,属于电解质;②空气是混合物,不是电解质;③ Mg属于单质,能导电,但不是电解质也不是非电解质;④ CaO是纯净物,属于电解质;⑤H2SO4 属于纯净物,属于电解质;⑥氢氧化钡是纯净物,属于电解质;⑦饱和FeCl3溶液属于混合物,不是电解质;⑧氨水是混合物,不是电解质;⑨HNO3是纯净物,属于电解质;⑩胆矾是纯净物,属于电解质;
(2)酸碱中和反应的实质是H++OH-=H2O;
(3)实验室制备Fe(OH)3胶体的方法是:将饱和的FeCl3溶液滴入沸水中,加热至溶液变为红褐色,得到的即为Fe(OH)3胶体;反应的方程式为:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;利用丁达尔效应检验胶体;
Fe(OH)3(胶体)+3H+;利用丁达尔效应检验胶体;
(4)实验室制备硫酸铜溶液,可选择胆矾(⑩),实验室没有900ml的容量瓶,因此选择1000ml的容量瓶,根据公式m=cVM计算需要溶质的质量并进行SO42-的数目的计算。
(1)根据分析可知:②⑦⑧属于混合物;①④⑤⑥⑨⑩时电解质;
(2)H++OH-=H2O表示的是酸碱发生中和生成可溶性盐的反应,即氢氧化钡(⑥)和硝酸(⑨)反应;
(3)由分析可知,实验室制备少量Fe(OH)3胶体所用的物质有饱和的FeCl3溶液(⑦)和水(①);反应的方程式为:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;利用丁达尔效应检验胶体,即用激光笔照射,侧面若有一条明亮的光路,则证明有胶体生成;
Fe(OH)3(胶体)+3H+;利用丁达尔效应检验胶体,即用激光笔照射,侧面若有一条明亮的光路,则证明有胶体生成;
(4)需要称取胆矾的质量m=cVM= 0.1mol/L×1L×250g/mol=25.0g;从1000ml 0.1mol/L的硫酸铜溶液中取出300ml,溶液中SO42-的物质的量为0.3L×0.1mol/L=0.03mol,因此含有SO42-的数目为0.03NA。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________。
(2)A与F形成离子化物FA的电子式为___________。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________。16g该物质反应转移的电子数目为________。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________(简要说明原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
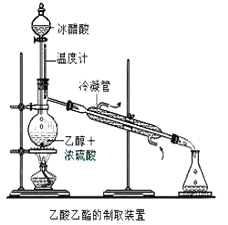
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化是氧化还原反应的是
A.CaO+CO2=CaCO3B.SiO2+2NaOH=Na2SiO3+H2O
C.NH4HCO3![]() NH3↑+H2O+CO2↑D.2FeSO4
NH3↑+H2O+CO2↑D.2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
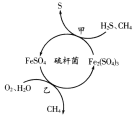
A.过程甲中发生反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B.脱硫过程O2间接氧化H2S
C.该脱硫过程需要不断添加Fe2(SO4)3溶液
D.过程乙发生反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
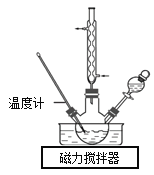
①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com