
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
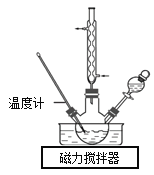
①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
【答案】ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +![]() NaClO碱性溶液 防止过量的NaClO溶液将水合肼氧化 20℃(冷)水浴(或缓慢通入CH3ONO气体) 蒸馏 蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥
NaClO碱性溶液 防止过量的NaClO溶液将水合肼氧化 20℃(冷)水浴(或缓慢通入CH3ONO气体) 蒸馏 蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥
【解析】
(1)①NaClO的碱性溶液与尿素CO(NH2)2水溶液反应生成N2H4·H2O,NaCl、Na2CO3,据此写出离子方程式;
②因为水合肼具有强还原性,易被次氯酸钠溶液氧化,可以通过分液漏斗控制NaClO碱性溶液的滴加速度,以此控制用量;
(2)①该反应在20℃左右反应的选择性和转化率最高,所以应设法把温度控制在20℃左右,据此分析实验时可以采取的措施;
②从混合液中可以采用蒸馏的方法回收甲醇;
③由B溶液获得叠氮化钠(NaN3)产品,需考虑先让叠氮化钠从溶液中结晶析出(蒸发浓缩、(冷却)结晶),过滤(布氏漏斗),洗涤(易溶于水,需采用非水洗液,常用乙醇,不使用乙醚,是因为还要考虑杂质离子的去除及环境保护),烘干(具有强还原性,需考虑隔绝空气)。
①NaClO碱性溶液与尿素CO(NH2)2水溶液制取N2H4·H2O,则反应物为ClO-、OH-、CO(NH2)2,生成物为N2H4·H2O、Cl-、CO32-(C由+2价被氧化为+4价的CO2,再与OH-反应),反应的离子方程式为ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +![]() 。
。
答案为:ClO- + CO(NH2)2 +2OH- = Cl- + N2H4·H2O +![]() ;
;
②因为水合肼具有强还原性,防止过量的NaClO溶液将水合肼氧化,所以需控制NaClO的用量,实验中通过分液漏斗滴加的溶液是NaClO碱性溶液;
答案为:防止过量的NaClO溶液将水合肼氧化;
(2)①该反应在20℃左右反应的选择性和转化率最高,所以应设法把温度控制在20℃左右,实验时可以采取的措施是20℃(冷)水浴(或缓慢通入CH3ONO气体);
答案为:20℃(冷)水浴(或缓慢通入CH3ONO气体);
②步骤Ⅱ为从溶液中回收CH3OH,则其实验操作名称为蒸馏;
答案为:蒸馏;
③由B溶液获得叠氮化钠(NaN3)产品,需考虑先让叠氮化钠从溶液中结晶析出(蒸发浓缩、(冷却)结晶),过滤(布氏漏斗),洗涤(易溶于水,需采用非水洗液,常用乙醇,不使用乙醚,是因为还要考虑杂质离子的去除及环境保护),烘干(具有强还原性,需考虑隔绝空气);
答案为:蒸发浓缩、(冷却)结晶,用布氏漏斗抽滤(过滤),晶体用乙醇洗涤2~3次,真空干燥箱干燥。


科目:高中化学 来源: 题型:
【题目】已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题:
(1)属于混合物的是__________ (填序号,下同),属于电解质的是__________ 。
(2)上述物质中__________与__________在水溶液中可发生反应,且离子方程式为H++OH-=H2O。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________,反应的离子方程式为__________;证明有Fe(OH)3胶体生成的实验操作及现象是__________
(4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为__________g,从配制好的溶液中取出300mL,其中含有SO42-的数目为__________(设
NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CH4的质量是_____________,在标准状况下的体积为____________;含电子的物质的量是_____________。
(2)同温同压下,等质量的O2和CO2 ,物质的量之比为______________,原子个数比为_____________,密度比为_______________。
(3)下列数量的各物质所含原子数按由大到小的顺序排列是____________________。
①0.5 mol氨气 ②标准状况下22.4 L氦气
③4 ℃时9 mL水 ④0.2 mol磷酸钠(Na3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
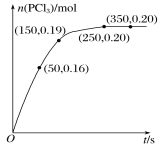
A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C.T ℃时,该反应的化学平衡常数K=0.025
D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列各组离子一定能大量共存的是( )
A.滴入石蕊试液显红色的溶液:K+、Mg2+、AlO2、SO32
B.1.0mol·L1的KNO3溶液:H+、Fe2+、Cl、SO42
C.在![]() =1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
D.通入足量CO2的溶液:Ca2+、Cl、K+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
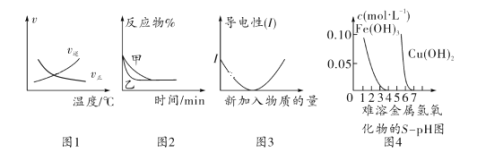
A.根据图1可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的 ΔH<0
2AB3(g)”的 ΔH<0
B.图2可能表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
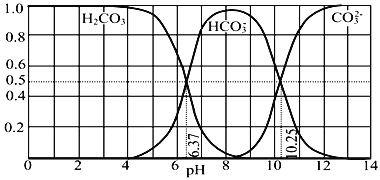
A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。液体A和气体B的组合不可能是( )
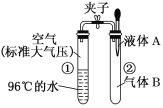
A. 氢氧化钠溶液、一氧化氮
B. 水、氨气
C. 氢氧化钠溶液、二氧化碳
D. 水、二氧化氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com