
【题目】在室温下,下列各组离子一定能大量共存的是( )
A.滴入石蕊试液显红色的溶液:K+、Mg2+、AlO2、SO32
B.1.0mol·L1的KNO3溶液:H+、Fe2+、Cl、SO42
C.在![]() =1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
D.通入足量CO2的溶液:Ca2+、Cl、K+、Na+
科目:高中化学 来源: 题型:
【题目】下列变化是氧化还原反应的是
A.CaO+CO2=CaCO3B.SiO2+2NaOH=Na2SiO3+H2O
C.NH4HCO3![]() NH3↑+H2O+CO2↑D.2FeSO4
NH3↑+H2O+CO2↑D.2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol N2与4 mol H2混合充分反应,则反应中转移的电子数目为6 mol
B.反应2Mg(s)+CO2(g)= C(s)+2MgO(s) 能自发进行,则该反应的ΔH>0
C.向0.1 mol·L1 CH3COONa溶液中加入少量水,溶液中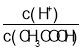 减小
减小
D.在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L1 的NaOH溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() >H2CO3>
>H2CO3>![]() >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将![]() 转变为
转变为![]() 的最佳方法是
的最佳方法是
A. 与稀H2SO4共热后,加入足量的NaOH溶液
B. 与稀H2SO4共热后,加入足量的Na2CO3溶液
C. 与足量的NaOH溶液共热后,再通入足量CO2
D. 与足量的NaOH溶液共热后,再加入适量H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
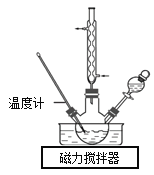
①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.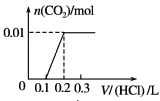 B.
B.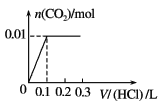
C.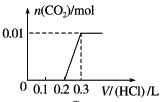 D.
D.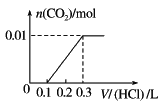
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的lg![]() 。25℃时,用0.100molL-1的NaOH溶液滴定20.00mL 0.100molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
。25℃时,用0.100molL-1的NaOH溶液滴定20.00mL 0.100molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
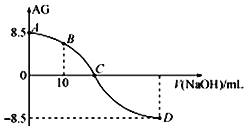
A. D点溶液的pH=11.25
B. C点之前溶液显碱性,C点之后溶液显酸性
C. C点时,加入NaOH溶液的体积为20mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
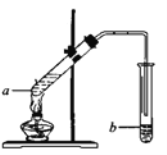
【题目】很多鲜花和水果的香味都来自酯的混合物。下图是乙烯等为原料制取乙酸乙酯的过程(部分产物和反应条件已略去)。
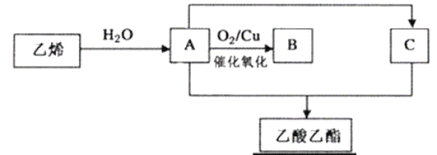
请回答下列问题:
(1)B的结构简式为______________。
(2)乙烯与水反应生成A的反应类型为______________。
(3)A与C反应生成乙酸乙酯的化学方程式为__________,其反应类型为__________。
(4)实验室可用如图装置制取乙酸乙酯。
①在试管a中加好相关试剂后,还需要加入2—3块的碎瓷片,其作用是__________。
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯在该溶液的_______(填“上”或“下”)层,用分液的方法分离出该产品所需的主要仪器是________。试管b中的导管口应在液面上方而不伸入到液面以下,其原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com