
【题目】下列说法正确的是
A.1 mol N2与4 mol H2混合充分反应,则反应中转移的电子数目为6 mol
B.反应2Mg(s)+CO2(g)= C(s)+2MgO(s) 能自发进行,则该反应的ΔH>0
C.向0.1 mol·L1 CH3COONa溶液中加入少量水,溶液中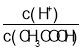 减小
减小
D.在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L1 的NaOH溶液混合,放出的热量大于57.3 kJ
【答案】D
【解析】
A.因为N2与H2的反应为可逆反应,所以1 mol N2与4 mol H2混合充分反应,实际参加反应的N2物质的量小于1mol,则反应中转移的电子数目小于6 mol,A错误;
B. 反应2Mg(s)+CO2(g)= C(s)+2MgO(s)能自发进行,因为ΔS<0,所以该反应的ΔH<0,B错误;
C. 向0.1 mol·L1 CH3COONa溶液中加入少量水,溶液中c(CH3COO-)、c(OH-)减小,c(H+)增大,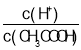 增大,C错误;
增大,C错误;
D. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L1 的NaOH溶液混合,因为浓硫酸溶解放热,放出的热量为溶解热与中和热之和,所以放出的热量大于57.3 kJ,D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】(1)绿色植物是空气天然的“净化器”,在家里科学选种一些绿色植物,可以达到净化空气、吸收有害物质的作用。科学研究发现,1公顷柳杉每月可以吸收160 kg SO2,则1公顷柳杉每月吸收的SO2的物质的量为________。
(2)铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混合、压制,就可以制成不同型号的铅笔芯。如果某铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1 mg。那么一个铅笔字含有的碳原子数约为________。
(3)吸食“摇头丸”会严重破坏人体的中枢神经,“摇头丸”的化学式为C9H13N,请计算:
①“摇头丸”的摩尔质量为________;
②某毒枭被查获带有270 g“摇头丸”,该毒枭所带的“摇头丸”的物质的量为________。
(4)将14.3 g Na2CO3·10H2O固体溶于水配成250 mL溶液,则所得溶液物质的量浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一定体积的容器中发生反应:A(s)+3B(g)![]() 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是( )
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是( )
①A的质量不发生变化 ②单位时间内生成a mol A,同时消耗2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤n(A):n(B):n(C):n(D)=1:3:2:2 ⑥B的浓度不变
A. ①③⑤⑥B. ①③④⑥C. ②④⑤D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠可用作碘的助溶剂,是制备碘化物的原料。化学实验小组用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。
已知:①水合肼(N2H4·H2O)的沸点118℃,100℃开始分解;具有强还原性。②I-、IO3-在碱性条件下共存,酸性条件下反应生成I2。化学实验小组用下图所示装置制备碘化钠,实验步骤如下:
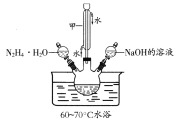
Ⅰ.制备水合肼:用:NaC1O氧化NH3制得水合肼,并将所得溶液装入上述装置左侧分液漏斗。
Ⅱ.向三颈烧瓶中加入一定量单质碘,打开右侧分液漏斗活塞,加入足量NaOH溶液,保持60~70℃水浴,充分反应得到NaI和NaIO3的混合溶液。
Ⅲ.打开左侧分液漏斗活塞,将水合肼溶液加入三颈瓶,并保持60~70℃水浴至反应充分。
Ⅳ.向Ⅲ所得溶液中加入适量活性炭,煮沸半小时,过滤,从滤液中分离出产品。
回答下列问题:
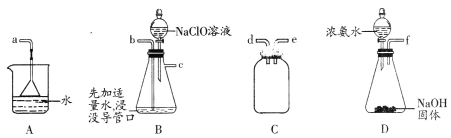
(1)仪器甲的名称是________________。
(2)用下图所示装置制备水合肼:
①仪器的接口依次连接的合理顺序是________________________(用字母表示)。
②实验过程中,需要缓慢滴加NaC1O溶液的主要原因是____________________________。
(3)步骤Ⅲ中温度保持在70℃以下的原因是_______________________________________。
(4)步骤Ⅳ中分离出产品的操作是_____________________、洗涤、干燥。
(5)设计方案检验步骤Ⅲ所得溶液中含有NaIO3:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CH4的质量是_____________,在标准状况下的体积为____________;含电子的物质的量是_____________。
(2)同温同压下,等质量的O2和CO2 ,物质的量之比为______________,原子个数比为_____________,密度比为_______________。
(3)下列数量的各物质所含原子数按由大到小的顺序排列是____________________。
①0.5 mol氨气 ②标准状况下22.4 L氦气
③4 ℃时9 mL水 ④0.2 mol磷酸钠(Na3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8gO2含有8NA个质子
B.分子总数为NA的CO2和NO2混合气体中含有的氧原子数为2NA
C.标准状况下,22.4L盐酸含有NA个HC1分子
D.分子总数为NA的CO、N2混合气体体积约为22.4L,质量为28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列各组离子一定能大量共存的是( )
A.滴入石蕊试液显红色的溶液:K+、Mg2+、AlO2、SO32
B.1.0mol·L1的KNO3溶液:H+、Fe2+、Cl、SO42
C.在![]() =1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3
D.通入足量CO2的溶液:Ca2+、Cl、K+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com