
【题目】一定温度下,一定体积的容器中发生反应:A(s)+3B(g)![]() 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是( )
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是( )
①A的质量不发生变化 ②单位时间内生成a mol A,同时消耗2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤n(A):n(B):n(C):n(D)=1:3:2:2 ⑥B的浓度不变
A. ①③⑤⑥B. ①③④⑥C. ②④⑤D. ②③④
【答案】B
【解析】
①A的质量不发生变化,可以说明反应达到平衡状态;
②单位时间内生成a mol A,一定同时消耗2a mol C,和反应是否达到平衡没有关系,故不能说明反应达到平衡状态;
③该反应前后气体系数之和不相等,在一定温度和体积的容器中,压强和气体总的物质的量成正比,所以压强不再变化可以说明反应达到了平衡状态;
④混合气体的密度等于混合气的质量除以容器的体积。该反应中A为固体,所以混合气的质量在未平衡前是变化的,容器的体积是不变的,所以混合气的密度在未平衡前是一变量,达到平衡后才不再变化,所以混合气体的密度不再变化可以证明反应达到了平衡状态;
⑤平衡时各物质的物质的量不再变化,而不是平衡时各物质的物质的量的比等于方程式的系数比,故n(A):n(B):n(C):n(D)=1:3:2:2不能说明反应是否达到了平衡状态;
⑥B的浓度不变说明反应达到了平衡状态。综合以上分析,①③④⑥正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列反应能用勒夏特列原理解释的是
A. 加入催化剂有利于氨的合成
B. 煅烧粉碎的黄铁矿矿石有利于SO2的生成
C. 硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化是氧化还原反应的是
A.CaO+CO2=CaCO3B.SiO2+2NaOH=Na2SiO3+H2O
C.NH4HCO3![]() NH3↑+H2O+CO2↑D.2FeSO4
NH3↑+H2O+CO2↑D.2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有:SiO2、Na2O、CaO、CuO、Fe2O3。现将该固体进行如下实验(所加试剂均过量):
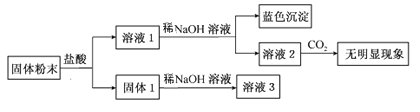
下列说法正确的是( )
A.该混合物一定含有CuO、SiO2,可能含有Na2O
B.该混合物可能含有Fe2O3
C.该混合物一定不含CaO和Na2O
D.无法确定是否含有CaO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
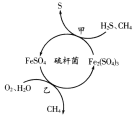
A.过程甲中发生反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B.脱硫过程O2间接氧化H2S
C.该脱硫过程需要不断添加Fe2(SO4)3溶液
D.过程乙发生反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol N2与4 mol H2混合充分反应,则反应中转移的电子数目为6 mol
B.反应2Mg(s)+CO2(g)= C(s)+2MgO(s) 能自发进行,则该反应的ΔH>0
C.向0.1 mol·L1 CH3COONa溶液中加入少量水,溶液中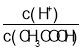 减小
减小
D.在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L1 的NaOH溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com