
����Ŀ��(1)��ɫֲ���ǿ�����Ȼ���������������ڼ����ѧѡ��һЩ��ɫֲ����Դﵽ���������������к����ʵ����á���ѧ�о����֣�1������ɼÿ�¿�������160 kg SO2����1������ɼÿ�����յ�SO2�����ʵ���Ϊ________��
(2)Ǧ��о����Ҫ�ɷ���ʯī���������Щ���ʰ��ղ�ͬ�ı������Ի�ϡ�ѹ�ƣ��Ϳ����Ƴɲ�ͬ�ͺŵ�Ǧ��о�����ijǦ��о������һ��ɷ���ʯī������Ǧ��дһ�������ĵ�����ԼΪ1 mg����ôһ��Ǧ���ֺ��е�̼ԭ����ԼΪ________��
(3)��ʳ��ҡͷ�����������ƻ��������������ҡͷ�����Ļ�ѧʽΪC9H13N������㣺
����ҡͷ������Ħ������Ϊ________��
��ij���ɱ�������270 g��ҡͷ�������ö�����������ҡͷ���������ʵ���Ϊ________��
(4)��14.3 g Na2CO3��10H2O��������ˮ���250 mL��Һ����������Һ���ʵ���Ũ����________��
���𰸡�2500 mol 2.5��1019 135g/mol 2 mol 0.2mol/L
��������
(1)����n=![]() ����SO2�����ʵ�����
����SO2�����ʵ�����
(2)����һ�������ĵ�����ԼΪ1 mg��Ǧ��о������һ��ɷ���ʯī������n=![]() ���������ʵ�����Ȼ������N=n��NA�������к��е�Cԭ����Ŀ��
���������ʵ�����Ȼ������N=n��NA�������к��е�Cԭ����Ŀ��
(3)�ٸ���Ħ����������Է���������ϵ���㣻
�ڸ���n=![]() ������ҡͷ���������ʵ�����
������ҡͷ���������ʵ�����
(4)����c=![]() ������Һ�����ʵ���Ũ�ȡ�
������Һ�����ʵ���Ũ�ȡ�
(1)160kgSO2�����ʵ���n=![]() =2500mol��
=2500mol��
(2)��һ������������ԼΪ1 mg��Ǧ��о������һ��ɷ���ʯī����һ�����к���Cԭ�ӵ����ʵ���Ϊn=![]() mol�������к��е�Cԭ����ĿΪN=nNA=
mol�������к��е�Cԭ����ĿΪN=nNA=![]() mol��6.02��1023/mol=2.5��1019��
mol��6.02��1023/mol=2.5��1019��
(3)��C9H13N����Է�������Ϊ��12��9+1��13+14=135����Ħ��������g/molΪ��λʱ����ֵ�ϵ�����Է��������������ҡͷ������Ħ������Ϊ135g/mol��
��270g��ҡͷ���������ʵ���n=![]() =2mol��
=2mol��
(4)14.3gNa2CO3��10H2O�����ʵ���n=![]() =0.05mol�����ø�̼���ƾ���������Һʱ������ΪNa2CO3�����ʵ����ʵ���n(Na2CO3)=0.05mol����������ʵ���Ũ�ȶ���ʽ��֪������Һ�����ʵ���Ũ��c=
=0.05mol�����ø�̼���ƾ���������Һʱ������ΪNa2CO3�����ʵ����ʵ���n(Na2CO3)=0.05mol����������ʵ���Ũ�ȶ���ʽ��֪������Һ�����ʵ���Ũ��c=![]() =0.2mol/L��
=0.2mol/L��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ��ͬѹ�£����и����Ȼ�ѧ����ʽ��Q2>Q1����( )
A. 2H2 (g)+O2 (g) == 2H2O(g)��H =��Q1 2H2 (g)+O2 (g) == 2H2O(l)��H = ��Q2
B. S(g)+O2 (g) ![]() SO2 (g)��H = ��Q1 S(s)+O2 (g)
SO2 (g)��H = ��Q1 S(s)+O2 (g) ![]() SO2 (g)��H = ��Q2
SO2 (g)��H = ��Q2
C. C(s)+O2 (g) == CO2 (g)��H = ��Q1 C(s)+1/2O2 (g) == CO(g)��H = ��Q2
D. H2(g)+Cl2(g) == 2HCl(g)��H =��Q1 1/2H2(g)+1/2Cl2(g) == HCl(g)��H =��Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ�����͵���
A. ������������ڰ��ĺϳ�
B. ���շ���Ļ������ʯ������SO2������
C. ������������98������������SO3��������H2O��ϡ��������SO3
D. ��ҵ��ȡ������Na(l)+KCl(l)![]() NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з����
NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ�������ȷ���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
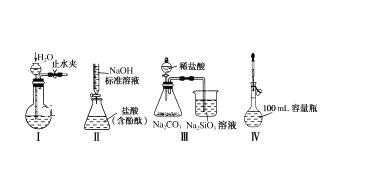
A.ʵ��װ�â��װ�õ�������
B.ʵ��װ�âⶨδ֪�����Ũ��
C.ʵ��װ�âȽ��ȡ�̼��������Ԫ�صķǽ�����ǿ��
D.ʵ��װ�â�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Һϳ����������IJ������£���Բ����ƿ�ڼ����Ҵ���Ũ��������ᣬƿ����ֱ��װͨ����ȴˮ�������ܣ�ʹ��Ӧ��������������ΪҺ��������ƿ�ڣ������Ȼ���һ��ʱ�������װ�ý�����������ͼ��ʾ�����õ������Ҵ��������ˮ�����������ֲ�Ʒ����ش��������⣺����֪���Ҵ������ᡢ���������ķе�������78.4�桢118�桢77.1��
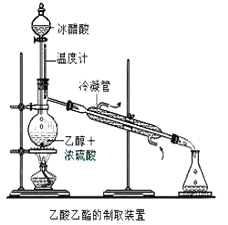
��1������ƿ�г��˼����Ҵ���Ũ����������⣬��Ӧ���뼸�����Ƭ����Ŀ����______________��
��2������ƿ�м���һ���������Ҵ���Ũ����Ļ��Һ�ķ����ǣ�_______________��
��3���ڸ�ʵ���У�����lmol�Ҵ���lmol������Ũ���������¼��ȣ���ַ�Ӧ���ܷ�����lmol����������ԭ����___________________��
��4��������뺬���ᡢ�Ҵ���ˮ�����������ֲ�Ʒ����ͼ�Ƿ��������������ͼ������ͼ��Բ�����������ʵ����Լ����ڷ������������ʵ��ķ��뷽����

�Լ�a��__________���Լ�b��_______________�����뷽������________�����뷽������__________�����뷽������________________��
��5���ڵõ���A�м�����ˮ̼���Ʒ�ĩ����Ŀ����____________________��
��6��д��C��D��Ӧ�Ļ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ�ء���ͼ��ʵ���ҴӺ�������ȡ������̵�һ���֡������ж���ȷ����

A. ����ܵIJ����ǹ���
B. ���õ�����Һ���鲽��ڵķ�Ӧ�Ƿ������ȫ
C. ����١��۵IJ����ֱ��ǹ��ˡ���ȡ
D. ������м�����л��ܼ������Ǿƾ������Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120����101.3 kPa�����飨CH4��������O2�Ļ����õ����ȼ��CH4+2O2=CO2+2H2O���ָ���ԭ�����¶Ⱥ�ѹǿ����÷�Ӧ�������ܶ�Ϊ��ͬ������H2�ܶȵ�15������ԭ��������м���������������Ϊ�� ��
A. 2��1B. 1��2C. 1��7D. 7��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��������ԭ��Ӧ����
A.CaO��CO2��CaCO3B.SiO2��2NaOH��Na2SiO3��H2O
C.NH4HCO3![]() NH3����H2O��CO2��D.2FeSO4
NH3����H2O��CO2��D.2FeSO4![]() Fe2O3��SO2����SO3��
Fe2O3��SO2����SO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.1 mol N2��4 mol H2��ϳ�ַ�Ӧ����Ӧ��ת�Ƶĵ�����ĿΪ6 mol
B.��Ӧ2Mg(s)+CO2(g)= C(s)+2MgO(s) ���Է����У���÷�Ӧ����H>0
C.��0.1 mol��L1 CH3COONa��Һ�м�������ˮ����Һ��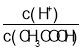 ��С
��С
D.��ϡ��Һ�У�H��(aq)+OH��(aq)= H2O(l) ��H= -57.3kJ��mol1��������0.5 mol H2SO4��Ũ������1 L 1.0 mol��L1 ��NaOH��Һ��ϣ��ų�����������57.3 kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com