
【题目】氯碱工业中电解饱和食盐水的原理如图所示.下列说法不正确的是( )
A.溶液A的溶质是NaOH
B.阴极附近溶液pH升高
C.气体a为氯气,其电极反应为2Cl﹣﹣2e﹣═Cl2↑
D.与产生气体b的电极相连的是电源的正极
【答案】D
【解析】A、依据装置图中钠离子的移动方向判断a端为阳极区氯离子失电子生成氯气,b端为阴极区,溶液中氢离子得到电子生成氢气,水的电离平衡正向进行,氢氧根离子浓度增大,溶液A中溶质为氢氧化钠,故A正确;
B、b端为阴极区,溶液中氢离子得到电子生成氢气,水的电离平衡正向进行,氢氧根离子浓度增大,溶液PH升高,故B正确;
C、装置图中钠离子的移动方向判断a端为阳极区氯离子失电子生成氯气,电极反应为2Cl﹣﹣2e﹣═Cl2↑,故C正确;
D、装置图中钠离子的移动方向判断a端为阳极区氯离子失电子生成氯气,b端为阴极区,溶液中氢离子得到电子生成氢气,与产生气体b的电极相连的是电源的负极,故D错误;
故选D.


科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于XOH型化合物而言,X是除H、O以外的其他元素时,下列说法中正确的是( )
A.XOH的水溶液不能导电B.当X是金属性很强的元素时,XOH一定是强碱
C.XOH一定是离子化合物D.XOH一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( ) 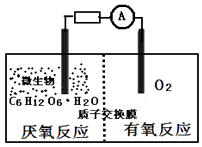
A.负极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程图如下: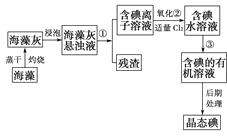
(1)指出提取碘的过程中有关的实验操作名称:
① , ③。
写出过程②中有关反应的离子方程式:。
(2)提取碘的过程中,可供选择的有机溶剂是( )(填序号)。
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是。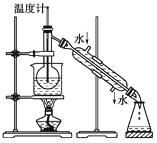
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①;
②;
③。
(5)进行上述蒸馏操作时,使用水浴的原因是 , 最后晶体碘在里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的性质的叙述中,不正确的是( )
A.苯是无色带有特殊气味的液体
B.常温下苯是一种不溶于水且密度小于水的液体
C.苯在一定条件下能与溴发生取代反应
D.苯不具有典型的双键所应具有的发生加成反应的特性,故不可能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.06mol FeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-被还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为( )
A. 0.4mol/L B. 0.2mol/L C. 0.1mol/L D. 0.08mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
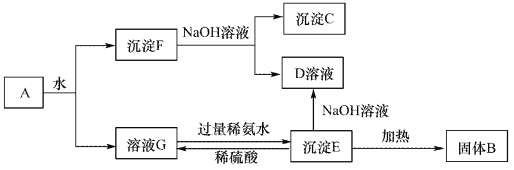
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
【答案】 Al2O3 + 2 OH-=AlO2-+H2O Fe2O3 + 6H+ =2 Fe3++3H2O Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4
【解析】根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;
将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,硫酸铝和氨水反应生成Al(OH)3和硫酸铵,(1)沉淀F与NaOH溶液反应的离子方程式为:Al2O3 + 2 OH-=AlO2-+H2O;(2)沉淀C为Fe2O3,Fe2O3与稀硫酸反应的离子方程式为:Fe2O3 + 6H+ =2 Fe3++3H2O;(3)溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4。
点睛:本题考查了常见物质的分离与提纯方法综合应用,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,A溶于水得沉淀F和溶液G,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G为硫酸铝溶液,沉淀F为氧化铝和氧化铁;将沉淀F溶于过量氢氧化钠溶液中,氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2溶液,溶液G中加入过量的氨水得到沉淀E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,据此进行解答。
【题型】综合题
【结束】
27
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:
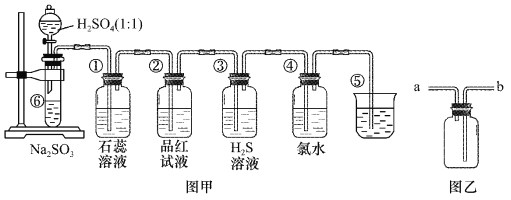
(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com