
| m |
| M |
| m |
| M |
| 82g |
| 164g/mol |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
A、羰基硫的电子式为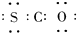 |
| B、羰基硫分子的中心原子为氧 |
| C、羰基硫中三个原子处于同一直线上 |
| D、羰基硫是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通式相同的不同物质一定属于同系物 |
| B、在相同条件下,燃烧等物质的量的C2H4和C2H5OH,消耗的O2体积相等 |
| C、相对分子质量相同的不同物质一定是同分异构体 |
| D、分子内有苯环和羟基的化合物一定是酚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1000Vd |
| 36.5V+22400 |
| Vd |
| 36.5V+22400 |
| 1000Vd |
| 36.5V+22.4 |
| 36.5V |
| 22.4(V+1)d |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
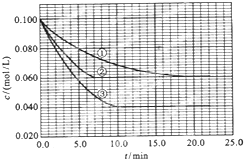 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200MOL/l及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200MOL/l及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com