
����Ŀ����ͼ��ij��˾���������ıʼDZ��������õļ״�ȼ�ϵ�صĹ���ʾ��ͼ���״��ڴ����������ṩ����(H��)�͵��ӣ����Ӿ�����·�����Ӿ��ڵ�·������һ����������Ӧ���õ���ܷ�ӦʽΪ��2CH3OH��3O2===2CO2��4H2O�������йظõ�ص�˵���������( )
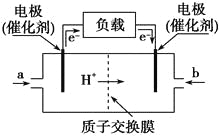
A. �ұߵĵ缫Ϊ��صĸ�����b��ͨ����ǿ���
B. ��ߵĵ缫Ϊ��صĸ�����a��ͨ����Ǽ״�
C. ��ظ����ķ�ӦʽΪ��2CH3OH��2H2O��12e��===2CO2����12H��
D. ��������ķ�ӦʽΪ��3O2��12H����12e��===6H2O
���𰸡�A
��������A������ԭ����е����Լ������ӵ��ƶ�����֪bΪ������������ͨ���������A����
B������ͼ�е������������ԭ����е����ǴӸ�����������������������һ���Ǹ�����ʧ���ӷ���������Ӧ������a����ʧ���ӵ�һ�ˣ�ͨ���Ǽ״�����B��ȷ��
C�������Ǽ״�ʧ���ӷ���������Ӧ�����ݵ�ط�Ӧ�����Ի�����2CH3OH+3O2=2CO2+4H2O�������缫��ӦΪ��CH3OH+H2O��6e��=CO2+6H+����C��ȷ��
D�������������õ����ӷ�����ԭ��Ӧ�������õ������������������ӣ���ͼ�������Խ��ʣ��缫��Ӧ����Ӧд��ˮ����ʽ����ص�������ӦʽΪ��O2+4H++4e��=2H2O����D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ���Т٢ڢܱۢ�ʾ��ͬ��ѧԪ������ɵĻ�����,ͼ�ұ�ʾ���ĸ����幹�ɵĻ��������˵������ȷ����(����)

A. ��ͼ���еĢڴ���������Ƥ�º�����������Χ�Ȳ�λ,�����֬��
B. ��ͼ���Т������ա����ݺ�ת������,��ܿ�����ˮ�Ҵ���ȡ
C. ͼ�����������ǰ�����,��û����ﳹ��ˮ���IJ�������ԭ��������3��
D. ͼ��������������������������,��û����ﳹ��ˮ���IJ�����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����ܲ����ܼ���˵������ȷ���ǣ�
A��ԭ�Ӻ�����ӵ�ÿһ���ܲ��������ɵĵ�����Ϊ2n2
B����һ�ܲ���ܼ����Ǵ�s�ܼ���ʼ�������ܼ�����һ�����ڸ��ܲ�����
C��ͬ��s�ܼ����ڲ�ͬ���ܲ����������ɵ����������Dz���ͬ��
D��1��ԭ�ӹ�������ֻ������2�����ӣ�������������ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ѿ��п��������IJ�������������SO2�ĺ������㣬�ҹ����ұ���GB2760��2014���涨���Ѿ���SO2�IJ�������0.25g/L��ij��ȤС�����ʵ�鷽�������Ѿ���SO2���вⶨ����Ʒ������£�
��1����ͼ��װ�ã��ӳ�װ���ԣ������ռ����SO2��ʵ��ʱB�м���100.00mL���Ѿ���Ʒ���������ᣬ����ʹSO2ȫ���ݳ�����C���ռ���֡�
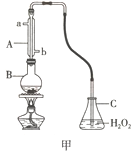
����C��ʢװH2O2��Һ����SO2������ȫ��Ӧ�Ļ�ѧ����ʽΪ_________________________����ȥC�й�����H2O2��Ȼ����0.04000mol/LNaOH����Һ���еζ����ζ�ǰ������ʱ��Ӧѡ��ͼ���е�_________������ţ�
�ڵζ����յ�����NaOH��Һ25.00mL���ݴ˼������Ѿ���SO2����Ϊ____________g/L��
��2����������ʱ�����ӷ����òⶨ�����ʵ��ֵƫ�ߣ���˸Ľ�ʵ�鷽��ʱ�ɽ������Ϊϡ���ᣬ���߲�ȡ���´�ʩ��
�ٽ�ͼ��װ��C��ʢװ��Һ���ΪH2O��������ӷ�������0.01000 mol/L ��I2��Һ�ζ�����Ӧ�Ļ�ѧ����ʽΪSO2+I2+2H2O=H2SO4+2HI����ѡ��________��ָʾ�����ζ��յ��������_____________��
��������Ȼ�Դ�ʵ�����ţ�������������ʵ������У����ڿ������������ã���ʹ�ⶨ���___________������ƫ������ƫ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�����һ��ʱ�����Һ�о��а�ɫ�������ɣ����н�������ȷ����
ʵ��� | ʵ��� | ʵ��� |
|
|
|
A. ʵ��������ɵij�����BaCO3
B. ʵ���������������
C. ʵ���������п��ܺ���BaSO4
D. ʵ�������ɳ��������ӷ���ʽ�ǣ�Ba2++ H2SO3===BaSO3��+2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£��������������ƿ�ڷֱ�װ�д�����NH3����һ�������HCl����, NO2 ��O2�Ļ������[V(NO2)��V(O2) = 4��1 ]��Ȼ��ֱ�����Ȫʵ�飬������ƿ��������Һ�����ʵ���Ũ��֮��Ϊ
A. 2��1��2 B. 5��5��4 C. 1��1��1 D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��HSO3��>I����������IO3��>I2���ں�3molNaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ������˵������ȷ����
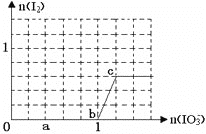
A. 0��a�䷢����Ӧ��3HSO3��+IO3��=3SO42-+I��+3H+
B. a��b�乲����NaHSO3�����ʵ���Ϊ1.8mol
C. b��c�䷴Ӧ��I2������������
D. ����Һ��I-��I2�����ʵ���֮��Ϊ5��3ʱ�������KIO3Ϊ1.1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ����ʵ������У��������( )
A. ��Ȼ�����ʾ�ˮ�⣬����������-�����ᡣ
B. ��������Һ�м������Na2SO4ʱ���ʹ���������ܽ�Ƚ��Ͷ�������
C. ��������Һ�м����Ҵ�����ʹ�����ʴ���Һ����������ˮ�����ܽ⡣
D. ����������ʱ���ս���ëζ��������������ë֯Ʒ����֯Ʒ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶���HF�ĵ��볣��Ka=4��10-4 ��CaF2���ܶȻ�����Ksp=1.46��10-10���ڸ��¶���ȡŨ��Ϊ0.25 mol��L-1��HF��Ũ��Ϊ0.002 mol��L-1��CaCl2��Һ�������ϡ�����˵����ȷ����
A. ���¶��£�0.25 mol��L-1��HF��Һ��pH=2
B. �����¶Ȼ�����Ũ�ȣ�HF�ĵ���ƽ�ⳣ����������
C. ����Һ��ϲ����������
D. �͵�CaF2��Һ�м�������CaCl2������ܶȻ�����Kspһ����֮ǰ��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com