
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。设计方案如下:
(1)用图甲装置(加持装置略)蒸馏并收集馏分SO2,实验时B中加入100.00mL葡萄酒样品和适量盐酸,加热使SO2全部逸出,在C中收集馏分。
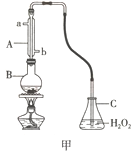
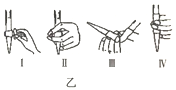
①若C中盛装H2O2溶液,则SO2与其完全反应的化学方程式为_________________________。除去C中过量的H2O2,然后用0.04000mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图乙中的_________(填序号)
②滴定至终点消耗NaOH溶液25.00mL,据此计算葡萄酒中SO2含量为____________g/L。
(2)由于蒸馏时盐酸易挥发,该测定结果比实际值偏高,因此改进实验方案时可将盐酸改为稀硫酸,或者采取以下措施:
①将图甲装置C中盛装的液体改为H2O,且馏分无挥发,改用0.01000 mol/L 标准I2溶液滴定,反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI,可选择________作指示剂,滴定终点的现象是_____________。
②盐酸虽然对此实验无干扰,但由于在上述实验过程中,存在空气的氧化作用,会使测定结果___________(填“偏高”“偏低”或“不变”)。
【答案】H2O2+SO2=H2SO4 III0.32淀粉溶液当最后一滴I2溶液滴下,溶液由无色变为蓝色,且30秒内不变色偏低
【解析】
(1)①双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用Ⅲ的方法;故答案为:SO2+H2O2=H2SO4;Ⅲ;
②根据2NaOH~H2SO4~SO2可知SO2的质量为:![]() ×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:
×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:![]() =0.32g/L,故答案为:0.32;
=0.32g/L,故答案为:0.32;
(2)①改用0.01000molL-1标准I2溶液滴定,选择淀粉溶液做指示剂,滴定终点的现象是:滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点,故答案为:淀粉溶液;当最后一滴I2溶液滴下,溶液由无色变为蓝色,且30秒内不变色;
②由于在上述实验过程中,存在空气的氧化作用,部分二氧化硫被氧化,使得消耗的标准溶液体积减小,测定结果偏低,故答案为:偏低。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】现有34 g 某气体,它的摩尔质量为17g.mol-1。则:
(1)该气体为_____________mol
(2)该气体所含分子数为_________ NA
(3)该气体在标准状况下的体积为_________ L
(4) ________g H2O中的氧原子数目与保准状况22.4LCO2中的氧原子数目相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为正盐。根据下列变化进行推断,回答有关问题:

(1)推断A、B、C、D的化学式:A________、B________、C________、D________。
(2)写出下列反应的离子方程式:
反应①生成气体B:__________________________________________________;
反应②白色沉淀溶解:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.钠和氯化铝溶液B.铝和烧碱溶液C.过氧化钠和氯化亚铁D.锌和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

回答下列问题:
(1)上述使用的氢溴酸的物质的量浓度为0.5mol/L,若用1.0mol/L的氢溴酸配制0.5mol/L的氢溴酸500mL,所需的玻璃仪器有玻璃棒、______________________________。
(2)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是_________,控制溶液的pH约为8.0的目的是___________________、_________________。
(3)试剂b是___________,步骤IV的目的是__________________。
(4)步骤V所含的操作依次是___________、过滤。
(5)制得的溴化钙可以通过如下步骤测定其纯度:①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应;④__________;⑤_________;⑥____________。若得到1.88g碳酸钙,则溴化钙的质量分数为_________。 若实验操作规范而测定结果偏低,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是
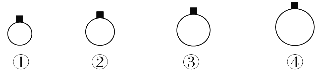
A. 气球②中装的是O2
B. 气球①和气球③中气体分子数相等
C. 气球③和气球④中气体密度之比为2∶1
D. 气球①和气球④中气体物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2===2CO2+4H2O。下列有关该电池的说法错误的是( )
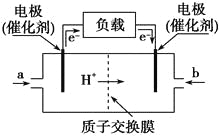
A. 右边的电极为电池的负极,b处通入的是空气
B. 左边的电极为电池的负极,a处通入的是甲醇
C. 电池负极的反应式为:2CH3OH+2H2O-12e-===2CO2↑+12H+
D. 电池正极的反应式为:3O2+12H++12e-===6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是( )
A. 铁锈的主要成分是Fe3O4
B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2
C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加过量铁粉,然后过滤
D. 因为Fe3+具有氧化性,所以可用来做净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F 在通常情况下均为气体,且A 与 C 物质的量之比为 1:1,B 为常见液体,F 为红棕色气体。
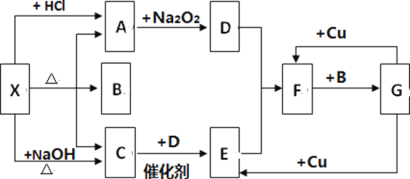
试回答下列问题:
(1)X 是_____;F 是_____。(写化学式)
(2)写出 G→E 反应的化学方程式并用双线桥标出电子转移的方向和数目_________。
(3)G 与 Cu 的反应中,G 表现__________性质。
(4)写出X→A 的离子方程式:__________。
(5)以 C、B、D 为原料可生产 G,若使 amolC 的中心原子完全转化到 G 中,理论上至少需要 D______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com