
【题目】某温度下HF的电离常数Ka=4×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.25 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
【答案】A
【解析】A、电离常数Ka(HF)=4×10-4,HF为弱电解质,不能完全电离,25℃时,0.25mol/LHF溶液中c(H+)=![]() =1×10-2mol/L,pH=2,选项A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,选项B错误;C、0.25 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L,在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,选项C错误;D、向饱和的CaF2溶液中少量CaCl2固体后,温度不变,溶度积常数Ksp不变,选项D错误。答案选A。
=1×10-2mol/L,pH=2,选项A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,选项B错误;C、0.25 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L,在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,选项C错误;D、向饱和的CaF2溶液中少量CaCl2固体后,温度不变,溶度积常数Ksp不变,选项D错误。答案选A。


科目:高中化学 来源: 题型:
【题目】下列有关有效碰撞模型说法不正确的是
A. 能发生有效碰撞的分子一定是活化分子
B. 有效碰撞是发生化学反应的充要条件
C. 不存在活化能为零的反应
D. 活化分子间的碰撞不一定是有效碰撞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】营养均衡有利于身体健康
(1)为人体提供能量的主要营养物质是糖类、____、蛋白质。
(2)蛋白质是构成人体细胞的基础物质,下列食品中富含蛋白质的是___(填序号)。
a.香蕉 b.牛奶 c.花生油 d.马铃薯
(3)维生素是人体需要的营养物质。右图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是____,甜味剂是__________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是( )
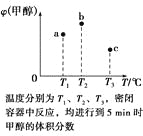
A. 正反应的ΔH>0
B. 反应进行到5 min时,b容器中v正=v逆
C. 减压可将b中的平衡状态转变成c中的平衡状态
D. 达到平衡时,a、b、c中CO的转化率为b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,PH相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________(填代号)
a.向NaClO溶液中加适量的水 b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水 d. 向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,不合理的是( )

A. 洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干
B. 用CCl4提取碘水中的碘,选③
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D. 粗盐提纯,选①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别装有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且乙的密度大于甲的密度,下列说法正确的( )
A. 甲的分子数比乙的分子数多 B. 甲的摩尔体积比乙的摩尔体积小
C. 甲的物质的量比乙的物质的量少 D. 甲的相对分子质量比乙的相对分子质量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(DME)-种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al203):2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:

则△H2=____。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的____(填正、负)极,通DME的电极反应为
Ⅱ.2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ/mol(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为

①________________________

(2)T=673K,合成氨反应的热化学方程式为______________
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4C1类似。写出盐酸肼第一步水解反应的离子方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com