
【题目】下列实验操作中,不合理的是( )

A. 洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干
B. 用CCl4提取碘水中的碘,选③
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D. 粗盐提纯,选①和②
科目:高中化学 来源: 题型:
【题目】有关物质结构的下列说法中正确的是( )
A. 碘升华时破坏了共价键
B. 含极性键的共价化合物一定是电解质
C. 氯化钠固体中的离子键在溶于水时被破坏
D. HF的分子间作用力大于HCl,故HF比HCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g) + Y(g)![]() 2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
A. 用X表示5min内此反应的反应速率是(0.1—0.2a)mol·(L·min)—1
B. 当混合气体的质量不再发生变化时,说明反应达到平衡状态
C. 向平衡后的体系中加入l mol M,平衡向逆反应方向移动
D. 向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=4×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.25 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前已开发出用电解法制取ClO2的新工艺。
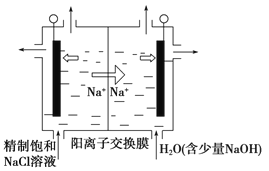
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.2 mol/L 的BaCl2溶液中含有的Cl-数目为0.4NA
B. 生成2.33 g BaSO4沉淀时,吸收SO2的体积约为 0.224 L
C. 常温常压下,17 g H2O2中所含分子总数为 0.5NA
D. 标准状况下,每转移1 mol电子,消耗1 mol H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A. 研制水溶剂涂料替代有机溶剂涂料
B. 用可降解塑料生产包装盒或快餐盒
C. 用反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O制备硫酸铜
CuSO4+SO2↑+2H2O制备硫酸铜
D. 用反应:2CH2=CH2+O2![]()
![]() 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com