
【题目】某有机物A,由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、C、D、E;C又可以转化为B、A。它们的转化关系如下:
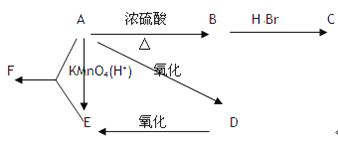
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、C、D、F的名称
A _________ ;C _________ ; D _________ ;F _________ 。
(2)指出实现下列转化的反应类型
C→A ____________ ;D→A ____________ ;C→B ____________ ;
(3)写出实现下列转化的化学方程式
A→B ___________________________ ;B→C _____________________________ ;
A→D ___________________________ ;A+E→F ___________________________ ;
D发生银镜反应 ____________________________________________________ 。
【答案】 乙醇 溴乙烷 乙醛 乙酸乙酯 取代反应(水解反应) 加成反应(还原反应) 消去反应 CH3CH2OH 浓硫酸170℃ CH2=CH2↑+ H2O CH2=CH2+HBr![]() CH3CH2Br 2CH3CH2OH+O2
CH3CH2Br 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O, CH3CHO+2{Ag(NH3)2}OH
CH3COOC2H5+H2O, CH3CHO+2{Ag(NH3)2}OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
【解析】D的蒸气密度是氢气的22倍,则相对分子质量为44,并可以发生银镜反应,说明含有-CHO,则D为CH3CHO,由转化关系可知E为CH3COOH,A为CH3CH2OH,B为CH2=CH2,C为CH3CH2Br,则F为CH3COOC2H5。
(1)由以上分析可知A为乙醇, C为溴乙烷, D为乙醛, F为乙酸乙酯;(2)CH3CH2Br→CH3CH2OH的反应类型为取代反应或水解反应; CH3CHO→CH3CH2OH的反应类型为加成反应或还原反应; CH3CH2Br→ CH2=CH2的反应类型为消去反应;(3)A→B的化学方程式为:CH3CH2OH![]() CH2=CH2↑+H2O; B→C的化学方程式为:CH2=CH2+HBr
CH2=CH2↑+H2O; B→C的化学方程式为:CH2=CH2+HBr![]() CH3CH2Br; A→D的化学方程式为:2CH3CH2OH+O2
CH3CH2Br; A→D的化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;A+E→F的化学方程式为:CH3COOH+CH3CH2OH
2CH3CHO+2H2O;A+E→F的化学方程式为:CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O;D发生银镜反应:CH3CHO+2{Ag(NH3)2}OH
CH3COOC2H5+H2O;D发生银镜反应:CH3CHO+2{Ag(NH3)2}OH![]() CH3COONH4+2Ag↓+3NH3+H2O。
CH3COONH4+2Ag↓+3NH3+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我国科学家设计出一种装置(电解质溶液呈碱性),总反应为2CO2=2CO+O2。

(1)该装置实现了_______________(填“太阳能”“电能”“化学能”,下同)转化为_____________,最终转化为__________。
(2)x极发生了__________反应(填“氧化”或“还原”)Y极的电极反应:__________。
(3)反应完毕,该装置中的电解质溶液碱性__________ (填“增强”、“减弱”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A. N为正极,铁电极应与Y相连接
B. M电极反应式: CO(NH2)2+H2O-6e- = CO2↑+N2↑+6H+
C. 当N电极消耗0.25 mol气体时,则铁电极增重16 g
D. H十透过质子交换膜由右向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,2.24LCCl4含有的共价键数为0.42NA
B. 氢原子数为0.4NA的甲醇分子中含有的键数为0.4NA
C. 1![]() Fe溶于过量硝酸,电子转移数为2NA
Fe溶于过量硝酸,电子转移数为2NA
D. 14![]() 乙烯和丙烯混合气体中的氢原子数为2NA
乙烯和丙烯混合气体中的氢原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为___________(填字母序号)。
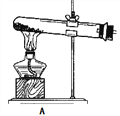

![]()

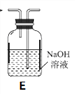
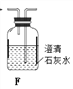
(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B的离子方程式_____________________________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?____________(选填“能”或“不能”);简述你的理由:__________________________________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.00mL。
①所用指示剂为_______________;滴定终点时的现象为_________________________;
②H2C2O4溶液物质的量浓度为_______________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A. 滴定管在盛装NaOH溶液前未润洗
B. 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C. 滴定前读数正确,滴定终点时俯视读数
D. 滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满。回答下列问题:
(1)B、C中第一电离能较大的是______________(填元素符号),基态D原子价电子的轨道表达式为______________。
(2)DA2分子的VSEPR模型是______________。H2A比H2D熔沸点高得多的原因是______________。

(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______________晶体(填晶体类型),其中C原子的杂化轨道类型为______________杂化。
②[C(OH)4]-中存在的化学键有______________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是__________。

(5)B、C的氟化物晶格能分别是2957kJ·mol-1、5492kJ·mol-1,二者相差很大的原因是______________。
(6)D与E所形成化合物晶体的晶胞如右图所示。
①在该晶胞中,E的配位数为____________。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(![]() ,0,
,0,![]() );c为(
);c为(![]() ,
,![]() ,0)。则d原子(面心上)的坐标参数为______________。
,0)。则d原子(面心上)的坐标参数为______________。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为______________pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水溶液中的离子平衡是中学化学的重要知识。
①25℃时,Na2CO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“CO32-”);升高温度可以__________(填“促进”或“抑制”)Na2CO3的水解;
②常温下,pH=2的盐酸,该溶液中c( HCl )= _________________ mol/L;
(2)12g碳与适量水蒸气反应生成CO和H2,需吸收131.3kJ热量,此反应的热化学方程式为_____________________(填字母代号)。
A.C + H2O == CO + H2 ΔH= +131.3 kJ·mol-1
B. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +10.94 kJ·mol-1
C. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +131.3 kJ·mol-1
体积为1 L的容恒密闭容器中,充入1.00 mol CO2和3.00 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
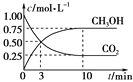
①从反应开始到平衡,二氧化碳的平均反应速率v(CO2)=______mol·(L·min)-1;
②该反应的平衡常数的表达式K= ___________________________;
③能说明该反应达到化学平衡状态的是__________(填字母代号);
A.c(CO2) = c(H2O) B.单位时间内消耗3mol H2,同时生成1mol CH3OH
C.容器内气体的压强不再变化
④下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.将H2O(g)从体系中分离 C.再充入1.00 mol CO2
(4)下图是实验室电解精炼铜装置,
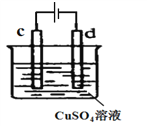
①d的电极材料为________________(填“粗铜”或“精铜”);
②c的电极反应方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·贵州省遵义市第四中学高一上学期期中考试)由NO和CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),下列关系正确的是
A.混合气体中,CO与NO质量比15∶14
B.混合气体中,CO与NO分子个数比1∶2
C.混合气体中,CO占有的体积大于NO占有的体积
D.混合气体中,CO与NO密度比14∶15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeOCr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:
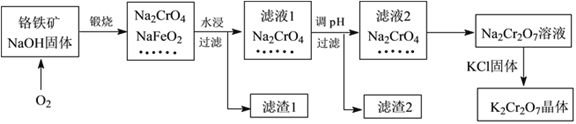
已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
请回答下列问题:
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有(填化学式)_________________;
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是_______(填字母代号);
a.溶液的颜色不变
b.v (CrO42—)= 2v (Cr2O72—)
c.Cr2O72—和CrO42—的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O72—和CrO42—,常用还原沉淀法处理。该方法的工艺流程为:
![]()
(4)请写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式___________________;
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,溶液的pH应调至__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com