
����Ŀ��A��B��C��D��E����ǰ������ԭ�������������������Ԫ�ء�A��Dͬ�����������ֳ���������DA2��DA3����ҵ�ϵ������C2A3��ȡ����C��B��E��������ֻ��2�������⣬�������ȫ�������ش��������⣺
��1��B��C�е�һ�����ܽϴ����______________����Ԫ�ط��ţ�����̬Dԭ�Ӽ۵��ӵĹ������ʽΪ______________��
��2��DA2���ӵ�VSEPRģ����______________��H2A��H2D�۷е�ߵö��ԭ����______________��

��3��ʵ����C����Ԫ���γɻ������ʵ�����ΪC2Cl6�������ģ����ͼ��ʾ����֪C2Cl6 �ڼ���ʱ���������������NaOH��Һ��Ӧ������Na[C(OH)4]��
��C2Cl6����______________���壨������ͣ�������Cԭ�ӵ��ӻ��������Ϊ______________�ӻ���
��[C(OH)4]���д��ڵĻ�ѧ����______________��
��4����ҵ���Ʊ�B�ĵ����ǵ������B���Ȼ�������ǵ��BA��ԭ����__________��

��5��B��C�ķ����ᄃ���ֱܷ���2957kJ��mol-1��5492kJ��mol-1���������ܴ��ԭ����______________��
��6��D��E���γɻ����ᄃ��ľ�������ͼ��ʾ��
���ڸþ����У�E����λ��Ϊ____________��
��ԭ����������ɱ�ʾ�����ڲ���ԭ�ӵ����λ�á���ͼ�����У�ԭ���������aΪ��0��0��0����bΪ��![]() ��0��
��0��![]() ����c��
����c��![]() ��
��![]() ��0������dԭ�ӣ������ϣ����������Ϊ______________��
��0������dԭ�ӣ������ϣ����������Ϊ______________��
����֪�þ������ܶ�Ϊ��g/cm3������������Dԭ��֮��ľ���Ϊ______________pm���г�����ʽ���ɣ���
���𰸡� Mg ![]() ƽ�������� H2O���Ӽ������� ���� sp3 ���Թ��ۼ�����λ�����ۼ�����λ���� ����MgCl2�ܵ��磬�ɵ�⣻MgO�۷е�ߣ��������MgO�ܺĴ� Al3+��Mg2+��ɸߡ��뾶С��AlF3�ľ����ܱ�MgF2��ö� 4 ��1��
ƽ�������� H2O���Ӽ������� ���� sp3 ���Թ��ۼ�����λ�����ۼ�����λ���� ����MgCl2�ܵ��磬�ɵ�⣻MgO�۷е�ߣ��������MgO�ܺĴ� Al3+��Mg2+��ɸߡ��뾶С��AlF3�ľ����ܱ�MgF2��ö� 4 ��1��![]() ��
��![]() ��
�� ![]() ��
��![]() ��1010
��1010
��������A��B��C��D��E����ǰ������ԭ�������������������Ԫ�ء�A��Dͬ�����������ֳ���������DA2��DA3��A��O��D��S����ҵ�ϵ������C2A3��ȡ����C��C��Al��B��E��������ֻ��2�������⣬�������ȫ����������B��Mg��E��Zn����1��þ��3s������Ӵ���ȫ����״̬���ȶ���ǿ����B��C�е�һ�����ܽϴ����Mg����̬Sԭ�Ӽ۵��ӵĹ������ʽΪ![]() ����2��SO2������Sԭ�ӵļ۲���Ӷ�����2��(6-2��2)/2=3������VSEPRģ����ƽ�������Ρ�����H2O���Ӽ�������������H2O��H2S�۷е�ߵöࡣ��3����������������˵��Al2Cl6���ڷ��Ӿ��壬������Al�γ�4�����ۼ�����Alԭ�ӵ��ӻ��������Ϊsp3�ӻ�����[Al(OH)4]���д��ڵĻ�ѧ������λ�������ۼ�����4����������MgCl2�ܵ��磬�ɵ�⣻MgO�۷е�ߣ��������MgO�ܺĴ����Թ�ҵ���Ʊ�Mg�ĵ����ǵ������Mg���Ȼ�������ǵ������þ����5��B��C�ķ�����������Ӿ��壬����Al3+��Mg2+��ɸߡ��뾶С�����AlF3�ľ����ܱ�MgF2��öࡣ��6���ٸ��ݾ����ṹ���жϸþ����У�Zn����λ��Ϊ4���ڸ��ݾ����ṹ������a��b��c��ԭ�����������֪dԭ�ӣ������ϣ����������Ϊ��1��
����2��SO2������Sԭ�ӵļ۲���Ӷ�����2��(6-2��2)/2=3������VSEPRģ����ƽ�������Ρ�����H2O���Ӽ�������������H2O��H2S�۷е�ߵöࡣ��3����������������˵��Al2Cl6���ڷ��Ӿ��壬������Al�γ�4�����ۼ�����Alԭ�ӵ��ӻ��������Ϊsp3�ӻ�����[Al(OH)4]���д��ڵĻ�ѧ������λ�������ۼ�����4����������MgCl2�ܵ��磬�ɵ�⣻MgO�۷е�ߣ��������MgO�ܺĴ����Թ�ҵ���Ʊ�Mg�ĵ����ǵ������Mg���Ȼ�������ǵ������þ����5��B��C�ķ�����������Ӿ��壬����Al3+��Mg2+��ɸߡ��뾶С�����AlF3�ľ����ܱ�MgF2��öࡣ��6���ٸ��ݾ����ṹ���жϸþ����У�Zn����λ��Ϊ4���ڸ��ݾ����ṹ������a��b��c��ԭ�����������֪dԭ�ӣ������ϣ����������Ϊ��1��![]() ��
��![]() �����۸��ݾ����ṹ��֪Znԭ�Ӹ�����8��1/8+6��1/2=4��Sԭ�Ӹ�����4����֪�þ������ܶ�Ϊ��g/cm3�����ı߳���
�����۸��ݾ����ṹ��֪Znԭ�Ӹ�����8��1/8+6��1/2=4��Sԭ�Ӹ�����4����֪�þ������ܶ�Ϊ��g/cm3�����ı߳���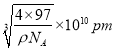 ����������Sԭ��֮��ľ���Ϊ��Խ��ߵ�һ�룬��Ϊ
����������Sԭ��֮��ľ���Ϊ��Խ��ߵ�һ�룬��Ϊ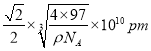 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л�Ϊͬϵ�����(����)
A. �����Ǻ�����B. ���Ǻ���ѿ��
C. ����ͱ���D. �Ҵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɢ�A��VA��Ԫ����ɵ����Ͳ������Ź㷺��;��
(1)B2H6��һ�ָ���ȼ�ϣ�����Cl2��Ӧ���ɵ�BCl3�����ڰ뵼����ӹ��ռ��ߴ������졣��BCl3��Ϊ�ȵ����壬���ɵڶ�����Ԫ����ɵ�һ��������Ϊ__________(�����ӷ���)��
(2)������(H3N��BH3)��Ti(BH4)3��Ϊ���ܹ�ע�����ͻ�ѧ�⻯�ﴢ����ϡ�
��H3N��BH3��Nԭ�ӵĹ���ӻ�����Ϊ________________��
��Ti(BH4)3��TiCl3��LiBH4��Ӧ�Ƶá���̬Ti3+��δ�ɶԵ�����Ϊ____________��BH4-�����幹����_______�����Ʊ���Ӧ�Ļ�ѧ����ʽΪ______________��
(3)�����������Ԫ��״������(HB=NH)3ͨ�����·�Ӧ�Ƶã�
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3��
����������������_____________
A.�������д�����λ��
B.��һ�����ܴ�С��ϵ��N>O>C>B>H
C.��Ӧǰ��̼ԭ�ӵ��ӻ����Ͳ���
D.CH4��H2O��CO2���ӿռ乹�ͷֱ��ǣ����������͡�V�͡�ֱ����
(3)GaAs���۵�Ϊ1238�棬�ܶ�Ϊ��g��cm-3���侧���ṹ��ͼ��ʾ���þ��������Ϊ_____________��Ga����λԭ��(As)��ĿΪ________��Ga��As��Ħ�������ֱ�ΪMGag��mol-1��MAsg��mol-1��ԭ�Ӱ뾶�ֱ�ΪrGacm��rAscm������٤������ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ__________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��������ڱ�������ͬ���������Ԫ�أ�����ԭ������Ϊx�����ҵ�ԭ��������������
A. x+2 B. x+4 C. x+8 D. x+18
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A����C��H��O����Ԫ����ɣ���һ����������A����ת��Ϊ�л���B��C��D��E��C�ֿ���ת��ΪB��A�����ǵ�ת����ϵ���£�
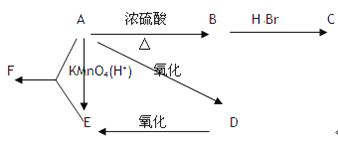
��֪D�������ܶ���������22���������Է���������Ӧ��
��1���A��C��D��F������
A _________ ��C _________ �� D _________ ��F _________ ��
��2��ָ��ʵ������ת���ķ�Ӧ����
C��A ____________ ��D��A ____________ ��C��B ____________ ��
��3��д��ʵ������ת���Ļ�ѧ����ʽ
A��B ___________________________ ��B��C _____________________________ ��
A��D ___________________________ ��A+E��F ___________________________ ��
D����������Ӧ ____________________________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β��ϵͳ�еĴ�ת����������Ч����β���е�CO��NO��NO2��������ŷš��ڴ�ת������ǰ�벿�����ķ�ӦΪ2CO(g) �� 2NO(g) ![]() 2CO2(g) �� N2(g)������˵���ܳ��˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2CO2(g) �� N2(g)������˵���ܳ��˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
A. CO��ת����100% B. CO��NO��CO2��N2��Ũ�����
C. CO��NO��CO2��N2�������й��� D. CO��NO��CO2��N2��Ũ�Ⱦ����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC4H10O�Ҳ��ܱ�������Ϊȩ���л����У� ��
A. 3��B. 4��C. 5��D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯����ͼ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵����ȷ����

A. ��Ӧ�����Ӱ뾶��X��W
B. ��Ӧ��̬�⻯����ȶ���Y��Z
C. ������XZW�Ⱥ����Ӽ����ֺ����ۼ�
D. Y������������Z���⻯���X������������Ӧ��ˮ�������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ϣ��[Cu(NH3)4]SO4�ĵ��뷽��ʽΪ��[Cu(NH3)4]SO4��[Cu(NH3)4]2����SO42-�� ����6�������Co3���������CoClm��n NH3����1 mol���������������AgNO3��Һ��Ӧֻ����1 mol AgCl��������m��n��ֵ�ֱ���
A��m��1��n��5 B��m��3��n��4
C��m��5��n��1 D��m��3��n��3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com