
【题目】已知信息:[Cu(NH3)4]SO4的电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。 具有6个配体的Co3+的配合物CoClm·n NH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m、n的值分别是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=3,n=3
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满。回答下列问题:
(1)B、C中第一电离能较大的是______________(填元素符号),基态D原子价电子的轨道表达式为______________。
(2)DA2分子的VSEPR模型是______________。H2A比H2D熔沸点高得多的原因是______________。

(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______________晶体(填晶体类型),其中C原子的杂化轨道类型为______________杂化。
②[C(OH)4]-中存在的化学键有______________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是__________。

(5)B、C的氟化物晶格能分别是2957kJ·mol-1、5492kJ·mol-1,二者相差很大的原因是______________。
(6)D与E所形成化合物晶体的晶胞如右图所示。
①在该晶胞中,E的配位数为____________。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(![]() ,0,
,0,![]() );c为(
);c为(![]() ,
,![]() ,0)。则d原子(面心上)的坐标参数为______________。
,0)。则d原子(面心上)的坐标参数为______________。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为______________pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物,它的合成路线如下:

(1)由B→C的反应类型为 。
(2)C分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式 。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(6)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(![]() )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚(  )和乙醇为原料制备
)和乙醇为原料制备  的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeOCr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:
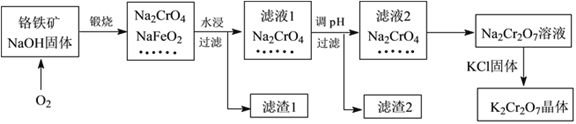
已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
请回答下列问题:
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有(填化学式)_________________;
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是_______(填字母代号);
a.溶液的颜色不变
b.v (CrO42—)= 2v (Cr2O72—)
c.Cr2O72—和CrO42—的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O72—和CrO42—,常用还原沉淀法处理。该方法的工艺流程为:
![]()
(4)请写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式___________________;
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,溶液的pH应调至__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是乙烷、乙烯、乙炔、苯中的一种;
①甲、乙能使溴的四氯化碳溶液褪色。乙与等物质的量的H2反应生成甲,甲与等物质的量的H2反应生成丙。
②丙既不能使溴的四氯化碳溶液褪色,也不能使KMnO4酸性溶液褪色。
③丁能使溴水褪色的原因与甲能使溴水褪色的原因不同,丁也不能使KMnO4酸性溶液褪色,但丁在一定条件下可与溴发生取代反应。相同条件下,丁蒸气的密度是乙密度的3倍。
据以上叙述完成下列问题:
(1)写出甲的结构简式__________、乙的结构式____________、丙分子中含有的化学键类型是__________;
(2)写出丁与液溴在催化剂作用下发生取代反应的方程式_________________;
(3)写出甲使溴的四氯化碳溶液褪色的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl=AgCl↓+KNO3。将含有少量氯化钾的硝酸钾固体提纯,某学生如图所示的实验操作。回答下列问题:

(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是___________。
(2)向溶液中加入适量的________溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误:①__________________;②______________________。
(4)为了从液体中得到硝酸钾晶体,可选用的两种结晶方法是:① __________________________ ;②______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碘水的下列说法中正确的是
A. 碘水中的分子只有水分子和碘分子B. 碘水呈紫黑色
C. 碘水能与氢氧化钠溶液反应D. 碘水不能与硝酸银溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下表中短周期主族元素的相关信息。
元素 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强喊性溶液 |
B | B的原子最外层电子数是其内层电子数的3倍 |
C | 在第三周期元素中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1) E在元素周期表中的位置是_____________________。
(2) X的化学式为____________________
(3) A、B、C三种元素形成的简单离子半径由大到小的顺序为________________ (用离子符号表示)。
(4)A的单质在真空高压下能与由元素D、E组成的化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com