
【题目】(1)水溶液中的离子平衡是中学化学的重要知识。
①25℃时,Na2CO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“CO32-”);升高温度可以__________(填“促进”或“抑制”)Na2CO3的水解;
②常温下,pH=2的盐酸,该溶液中c( HCl )= _________________ mol/L;
(2)12g碳与适量水蒸气反应生成CO和H2,需吸收131.3kJ热量,此反应的热化学方程式为_____________________(填字母代号)。
A.C + H2O == CO + H2 ΔH= +131.3 kJ·mol-1
B. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +10.94 kJ·mol-1
C. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +131.3 kJ·mol-1
体积为1 L的容恒密闭容器中,充入1.00 mol CO2和3.00 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
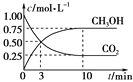
①从反应开始到平衡,二氧化碳的平均反应速率v(CO2)=______mol·(L·min)-1;
②该反应的平衡常数的表达式K= ___________________________;
③能说明该反应达到化学平衡状态的是__________(填字母代号);
A.c(CO2) = c(H2O) B.单位时间内消耗3mol H2,同时生成1mol CH3OH
C.容器内气体的压强不再变化
④下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.将H2O(g)从体系中分离 C.再充入1.00 mol CO2
(4)下图是实验室电解精炼铜装置,
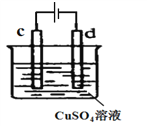
①d的电极材料为________________(填“粗铜”或“精铜”);
②c的电极反应方程式_______________________________。
【答案】 ![]() 促进 0.01 C 0.075
促进 0.01 C 0.075 ![]() C B 精铜 Cu- 2e- = Cu2+
C B 精铜 Cu- 2e- = Cu2+
【解析】试题分析:(1)①25℃时,Na2CO3水解呈碱性;水解吸热,升高温度水解平衡正向移动; ②盐酸是强酸,完全电离;
(2)反应吸收热量,焓变为正值,热化学方程式要标注反应物和生成物的状态。
(3)①结合图像数值,根据![]() 计算v(CO2);
计算v(CO2);
②该反应的平衡常数的定义书写表达式;
③根据化学平衡的定义分析达到化学平衡状态标志;
④根据平衡移动分析使n(CH3OH)/n(CO2)增大的措施。
(4)①精炼铜时粗铜做阳极、精铜做阴极;
②c与电源正极相连,c发生氧化反应。
解析:(1)①25℃时,Na2CO3是强碱弱酸盐,溶液呈碱性,原因是CO32-水解引起的;水解吸热,升高温度可以促进Na2CO3的水解,碱性增强;
②盐酸是强酸,完全电离,常温下,pH=2的盐酸, ![]() 0.01mol/L,所以溶液中c( HCl )=0.01 mol/L;
0.01mol/L,所以溶液中c( HCl )=0.01 mol/L;
(2)吸收热量,焓变为正值,热化学方程式要标注反应物和生成物的状态,反应的热化学方程式为C(s)+ H2O(g) == CO(g) + H2(g) ΔH = +131.3 kJ·mol-1;
(3)①从反应开始到平衡,二氧化碳的平均反应速率v(CO2)=![]() 0.075mol·(L·min)-1;
0.075mol·(L·min)-1;
②该反应的平衡常数的表达式K=  ;
;
③c(CO2) = c(H2O),都是正反应速率,不一定平衡,故A错误; B.单位时间内消耗3mol H2,同时生成1mol CH3OH,都是指正反应速率,不一定平衡,故B错误;
C.容器内气体的压强不再变化,说明气体物质的量不变,一定平衡,故C正确;
④反应放热,升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小,故A错误;将H2O(g)从体系中分离 ,平衡正向移动,n(CH3OH)/n(CO2)增大,故B正确;再充入1.00 mol CO2,CO2浓度增大,n(CH3OH)/n(CO2)减小,故C错误。
(4)①根据图示d是阴极、c是阳极,精炼铜时粗铜做阳极、精铜做阴极,所以d电极材料为精铜;
②c是阳极,铜失电子发生氧化反应,电极反应方程式为Cu- 2e- = Cu2+


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5 g/100 mL。用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如下图所示:

![]()
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、_____________________________。
(2)应选用__________作为指示剂。达到滴定终点时,指示剂从____色变为_____色。
(3)某同学一共进行了三次实验。以下是他设计的实验数据记录表,表格中A是______________,B是_______________。
实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
A | B | 消耗体积(mL) | ||
1 | 20.00 | 22.05 | ||
2 | 20.00 | 21.34 | ||
3 | 20.00 | 21.30 | ||
数据处理:消耗标准NaOH溶液的体积=______________mL。
若测得稀释后白醋的浓度0.0594 mol/L,则该食醋______(选填“符合”、“不符合”)国家标准。
标准NaOH溶液通过以下步骤准备:①配制500 mL浓度约为0.1 mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度。
(4)称量所需的NaOH固体置于大烧杯中,加入500 mL蒸馏水,搅拌溶解,该配制步骤____________
(填“可行”或“不可行”)。
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现__________色和__________色交替的现象。
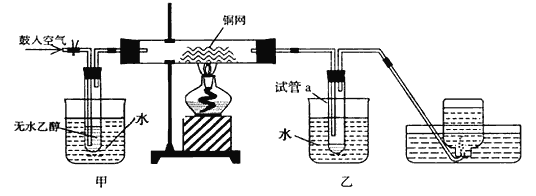
(2)甲和乙两个水浴作用不相同,其中甲中装的是热水,乙中装的是冷水。他们的作用依次为______________,________________。
(3)反应进行一段时间后,试管a中能 收集到若干种物质,其中一种液体能使紫色石蕊试纸显红色, 要除去该物质,可在混合液中加入_____________(填写字母)除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A,由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、C、D、E;C又可以转化为B、A。它们的转化关系如下:
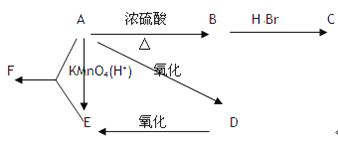
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、C、D、F的名称
A _________ ;C _________ ; D _________ ;F _________ 。
(2)指出实现下列转化的反应类型
C→A ____________ ;D→A ____________ ;C→B ____________ ;
(3)写出实现下列转化的化学方程式
A→B ___________________________ ;B→C _____________________________ ;
A→D ___________________________ ;A+E→F ___________________________ ;
D发生银镜反应 ____________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素基态原子电子排布式为______________。
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为__________。
(3)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____________(2分),试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式___________________________________________。
(4)写出E与D的最高价氧化物对应的水化物反应的化学方程式____________。
(5)离子半径:D+______B3-,电负性:C_______F。(填“<”、“>”或“=”)(各1分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《后汉书·郡国志》中记载:“石出泉水……其水有肥,燃之极明,不可食,县人谓之石漆。”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明。”下列说法正确的是 ( )
A. 上述材料所说“石漆”“石脂水”是石油,在工业上通过石油分馏得到苯和甲烷等
B. 塑料聚乙烯(PE)的单体可以由石油裂解得到
C. 聚乙烯可以使溴水褪色
D. 三大合成材料分别是合金、合成橡胶和合成纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅的说法不正确的是( )
A. 硅元素是地壳中含量仅次于氧的元素
B. 地壳中的岩石、沙子和土壤中都含有二氧化硅
C. 纯净的二氧化硅是一种无色透明的晶体
D. 二氧化硅是一种熔点高、硬度大、能溶于水的固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量:____________。定容时,向容量瓶中加水,至1~2cm时,改用_________加水至刻度,加盖摇匀;
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈 ⑤容量瓶未经干燥使用。 其中引起所配溶液浓度偏高的有______________(填序号,下同),偏低的有______________,无影响的有_______________________________。
(3)下列操作中,容量瓶所不具备的功能有________________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:

你认为该同学的错误步骤有_________________。
A.1处 B.2处 C.3处 D.4处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com