
����Ŀ��ʳ�����ճ���ʳ�е�һ�ֵ�ζ�������ұ��涨����ʳ���д��Ậ�����õ���3.5 g/100 mL�����к͵ζ��ķ������Բⶨʳ���д����Ũ�ȣ�ij�״Ĵ���Ũ�Ȳⶨ��������ͼ��ʾ��

![]()
���������գ�
��1��ϡ�Ͱ״�ʱ��Ҫ���������ձ���_____________________________��
��2��Ӧѡ��__________��Ϊָʾ�����ﵽ�ζ��յ�ʱ��ָʾ����____ɫ��Ϊ_____ɫ��
��3��ijͬѧһ������������ʵ�顣����������Ƶ�ʵ�����ݼ�¼����������A��______________��B��_______________��
ʵ����� | ϡ�ͺ�״� �����mL�� | ��NaOH��Һ | ||
A | B | ���������mL�� | ||
1 | 20.00 | 22.05 | ||
2 | 20.00 | 21.34 | ||
3 | 20.00 | 21.30 | ||
���ݴ��������ı�NaOH��Һ�����=______________mL��
�����ϡ�ͺ�״�Ũ��0.0594 mol/L�����ʳ��______��ѡ���������������������������ұ���
��NaOH��Һͨ�����²�������������500 mLŨ��ԼΪ0.1 mol/L��NaOH��Һ��
����KHC8H4O4����Һȷ�ⶨ��NaOH��Һ��Ũ�ȡ�
��4�����������NaOH�������ڴ��ձ��У�����500 mL����ˮ�������ܽ⣬�����Ʋ���____________
����������������������������
��5��NaOH����Һ��Ũ����ͨ���ⶨ������ֱ�����Ƶ�ԭ����__________________________��
���𰸡� ����������ͷ�ι���100mL����ƿ ��̪ ��ɫ dz��ɫ �ζ�ǰ������ �ζ������ 21.32 ���� ���� NaOH�����ڳ���ʱ�������տ����е�ˮ��CO2��ʹ�������õ���ҺŨ�ȵ���Ԥ��Ũ�ȣ�����ʵ����
����������1�����״�ϡ�ͳ�ʱ100mL������Ҫ���������ձ�������������ͷ�ιܡ�100mL����ƿ����2���������������ζ��״ף�Ӧѡ�÷�̪��Ϊָʾ�����״����̪����ɫ���ﵽ�ζ��յ�ʱ��ָʾ������ɫ��Ϊdz��ɫ����3��ʵ���ǽ�������к͵ζ�����¼���ǵζ�ǰ����Һ���������A�ǵζ�ǰ������B�ǵζ�����������ݱ������ݣ�ʵ��1���̫��Ӧȥ���������ı�NaOH��Һ�����=![]() L�������ϡ�ͺ�״�Ũ��0.0594 mol/L����ϡ��ǰ��Ũ��Ϊ0.0594 mol/L��
L�������ϡ�ͺ�״�Ũ��0.0594 mol/L����ϡ��ǰ��Ũ��Ϊ0.0594 mol/L��![]() 0.594 mol/L����Ϊ
0.594 mol/L����Ϊ![]() >3.5 g/100 mL����ʳ���Ϲ��ұ�����4�����������֪���������Ƶ�Ũ�Ȳ���Ҫȷ���ƣ����Բ���Ҫ����ƿ������ǿ��еģ���5��NaOH����Һ��Ũ����ͨ���ⶨ������ֱ�����Ƶ�ԭ����NaOH�����ڳ���ʱ�������տ����е�ˮ��CO2��ʹ�������õ���ҺŨ�ȵ���Ԥ��Ũ�ȣ�����ʵ����
>3.5 g/100 mL����ʳ���Ϲ��ұ�����4�����������֪���������Ƶ�Ũ�Ȳ���Ҫȷ���ƣ����Բ���Ҫ����ƿ������ǿ��еģ���5��NaOH����Һ��Ũ����ͨ���ⶨ������ֱ�����Ƶ�ԭ����NaOH�����ڳ���ʱ�������տ����е�ˮ��CO2��ʹ�������õ���ҺŨ�ȵ���Ԥ��Ũ�ȣ�����ʵ����


 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϲ��뺣�����ƣ���һ�ָ��������ĺ���ֲ���Ʒ�ϲ��ᱡ�ɴࡢ�Ⱥ������ױ����ճɻң���ʱ��ת��Ϊ�⻯�����Σ������ڵⵥ�ʵ���ȡ����֪:
�ҽ� | ���Ȼ�̼ | �ѻ����� | �⣨���壩 | |
�ܶ�gcm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
�е�/�� | 78.5 | 76.8 | 25~232 | 184.35 |
����Ϊij��ȤС��ģ����ϲ���ȡ�ⵥ�ʵĹ��̣�
![]()
(1)ʵ���ұ����ϲˣ���Ҫ���������е�___________������ţ���
a.�Թ� b.�ձ� c.���� d.������ e.������ f.�ƾ��� g.ȼ�ճ�
(2)���������õ��ϲ˻���������˫��ˮ��ϡ�������ã�д����Ӧ�����ӷ���ʽ___________��
(3)�����ٵ�������__________���Լ�AΪ_________ (��������һ����ѻ�ѧ�Լ������ƣ�����ʹ�����������Լ�����Ҫԭ��ֱ��ǣ�I_____________________��II __________________��
(4)������Ӧ��____________(�������ƣ��������ã��۲쵽��������______________��
(5)�÷������ó�ѹ��������������������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.����������CuƬ��ZnƬ����ʢ��1Lϡ������Һ���ձ��У��õ��������γ�ԭ��ء�����ͼ��ʾ��
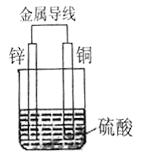
��ԭ��صĸ���������_____��(����ơ�)
ͭƬ�Ϸ�����Ӧ��������_____��Ӧ(���������ԭ��)
��һ��ʱ���ڣ�����·����2mol�ĵ��ӷ���ת��ʱ�������ϸ�װ���п��ռ�����___L(��״��)
II. һ���¶��£���2L�ĺ����ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ
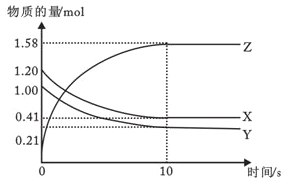
(1)��Ӧ�ӿ�ʼ��10sʱ����Y��Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ__________
(2)�÷�Ӧ�Ļ�ѧ����ʽΪ��______________
(3)�ں��º��ݵ��ܱ������У����������������ٷ����仯ʱ��һ��������Ϊ������Ӧ�ﵽƽ��ı�־��____________
�ٻ�������ѹǿ �ڻ��������ܶ� �ۻ������������ʵ��� ����ͬʱ���ڣ�X���ĵ����ʵ�����Z���ĵ����ʵ���֮��Ϊ1:2 �ݸ����ʱ�ʾ�ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮�� ��������ƽ����Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ����Ƴ�һ��װ��(�������Һ�ʼ���)���ܷ�ӦΪ2CO2=2CO+O2��

��1����װ��ʵ����_______________(�̫���ܡ������ܡ�����ѧ�ܡ�����ͬ��ת��Ϊ_____________������ת��Ϊ__________��
��2��x��������__________��Ӧ�����������ԭ����Y���ĵ缫��Ӧ��__________��
��3����Ӧ��ϣ���װ���еĵ������Һ����__________ (���ǿ���������������䡱)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֳ��£�N2H4,��ɫҺ�壩��һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϡ��ش��������⣺
��1���������ӵĵ���ʽΪ �����е��Ļ��ϼ�Ϊ ��
��2��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ ��
��3����2O2(g)+N2(g)==N2O4(l) ��H1
��N2(g)+2H2(g)==N2H4(l) ��H2
��O2(g)+2H2(g)==2H2O(g) ��H3
��2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) ��H4=-1048.9kJ-mol-1
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4= ��������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ ��
��4������Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ơ�������һ�����뷴Ӧ��ƽ�ⳣ��ֵΪ (��֪��N2H4+H+![]() N2H5+��K=8.7xl07; Kw=1.0xl0-14)�������������γɵ���ʽ�εĻ�ѧʽΪ ��
N2H5+��K=8.7xl07; Kw=1.0xl0-14)�������������γɵ���ʽ�εĻ�ѧʽΪ ��
��5��������һ�ֳ��õĻ�ԭ������װ������AgBr���Թ��м���������Һ���۲쵽�������� �����������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������1kg�������ɳ�ȥˮ���ܽ��O2 kg����ʹ��Na2S03����ˮ���ܽ��O2��ȣ��������ŵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����S2Cl2���ڹ�ҵ����������Ϊ��ʵ���Һϳ�S2Cl2��ij��ѧ�о���ѧϰС��������й����ϣ��õ�������Ϣ��
���������������110����140������Ӧ�����ɵ�S2Cl2��Ʒ��
���й����ʵIJ����������±���
���� | �۵�/�� | �е�/�� | ��ѧ���� |
S | 112.8 | 444.6 | �� |
S2Cl2 | ��77 | 137 |
S2Cl2+Cl2 2SCl2 |
���ʵ��װ��ͼ���£�

��1����ͼ�����巢����β������װ�ò������ƣ���������Ľ���� �����øĽ������ȷװ�ý���ʵ�飬��ش��������⣺
��2��B�з�Ӧ�����ӷ���ʽ�� ��E�з�Ӧ�Ļ�ѧ����ʽ�� ��
��3��C�е��Լ��� ��
��4������B�������� ��F�������� ��
��5������ڼ���Eʱ�¶ȹ��ߣ���ʵ������Ӱ���� ��
��6��S2Cl2��Ʒ�п��ܻ��е������ǣ���д���֣� ��Ϊ�����S2Cl2�Ĵ��ȣ��ؼ��IJ����ǿ��ƺ��¶Ⱥ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��������һ�����ォ��ˮ�е����ء�CO(NH2)2���Ļ�ѧ��ֱ��ת��Ϊ���ܣ������ɻ����Ѻ����ʵ�װ�ã�ͬʱ���ô�װ�õĵ��������϶�ͭ������˵������ȷ����

A. NΪ���������缫Ӧ��Y������
B. M�缫��Ӧʽ�� CO(NH2)2��H2O��6e�� = CO2����N2����6H��
C. ��N�缫����0.25 mol����ʱ�������缫����16 g
D. Hʮ�����ӽ���Ĥ���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ˮ��Һ�е�����ƽ������ѧ��ѧ����Ҫ֪ʶ��
��25��ʱ��Na2CO3��Һ�ʼ��ԣ�ԭ����___________ˮ������ģ��Na+����CO32-�����������¶ȿ���__________����ٽ��������ơ���Na2CO3��ˮ�⣻
�ڳ����£�pH=2�����ᣬ����Һ��c( HCl ��= _________________ mol/L��
��2��12g̼������ˮ������Ӧ����CO��H2��������131.3kJ�������˷�Ӧ���Ȼ�ѧ����ʽΪ_____________________������ĸ���ţ���
A.C + H2O == CO + H2 ��H= +131.3 kJ��mol-1
B. C(s)+ H2O(g) == CO(g) + H2(g) ��H= +10.94 kJ��mol-1
C. C(s)+ H2O(g) == CO(g) + H2(g) ��H= +131.3 kJ��mol-1
���Ϊ1 L���ݺ��ܱ������У�����1.00 mol CO2��3.00 mol H2��һ�������·�����Ӧ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H����49.00 kJ��mol��1
CH3OH(g)��H2O(g) ��H����49.00 kJ��mol��1
���CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��
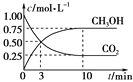
�ٴӷ�Ӧ��ʼ��ƽ�⣬������̼��ƽ����Ӧ����v(CO2)��______mol��(L��min)��1��
�ڸ÷�Ӧ��ƽ�ⳣ���ı���ʽK= ___________________________��
����˵���÷�Ӧ�ﵽ��ѧƽ��״̬����__________������ĸ���ţ���
A.c(CO2) = c(H2O) B.��λʱ��������3mol H2��ͬʱ����1mol CH3OH
C.�����������ѹǿ���ٱ仯
�����д�ʩ����ʹn(CH3OH)/n(CO2)�������________��
A�������¶� B����H2O(g)����ϵ�з��� C���ٳ���1.00 mol CO2
��4����ͼ��ʵ���ҵ�⾫��ͭװ�ã�
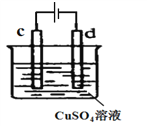
��d�ĵ缫����Ϊ________________�����ͭ����ͭ������
��c�ĵ缫��Ӧ����ʽ_______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com