
【题目】I.将等质量的Cu片、Zn片放入盛有1L稀硫酸溶液的烧杯中,用导线连接形成原电池。如下图所示:
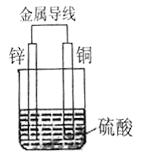
①原电池的负极材料是_____,(填“名称”)
铜片上发生反应的类型是_____反应(填“氧化”或“还原”)
②一段时间内,当电路中有2mol的电子发生转移时,理论上该装置中可收集气体___L(标准状况)
II. 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示
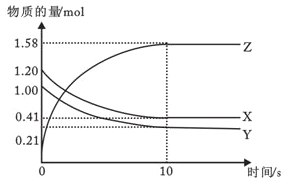
(1)反应从开始到10s时,用Y的浓度变化来表示的反应速率为__________
(2)该反应的化学方程式为:______________
(3)在恒温恒容的密闭容器中,当下列物理量不再发生变化时,一定可以作为上述反应达到平衡的标志是____________
①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④相同时间内,X消耗的物质的量与Z消耗的物质的量之比为1:2 ⑤各物质表示的反应速率之比等于化学计量数之比 ⑥混合气体的平均相对分子质量
【答案】 锌 还原 22.4 0.0395mol·L-1·s-1 X+Y![]() 2Z ④
2Z ④
【解析】I.①将等质量的Cu片、Zn片放入盛有1L稀硫酸溶液的烧杯中,用导线连接形成原电池,锌比铜活泼,锌为原电池的负极,铜为正极,发生还原反应,故答案为:锌;还原;
②一段时间内,当电路中有2mol的电子发生转移时,逐渐有2mol氢离子放电生成1mol氢气,标准状况下的体积为22.4L,故答案为:22.4;
II. (1)从反应开始到10s时,Y的物质的量变化为:1.00mol-0.21mol=0.79mol,则该段时间内用Y表示的反应速率为:v(Y)=![]() =0.0395molL-1s-1,故答案为:0.0395molL-1s-1;
=0.0395molL-1s-1,故答案为:0.0395molL-1s-1;
(2)由图象可以看出,反应中X、Y的物质的量减少,应该为反应物,Z的物质的量增多,应为生成物,当反应进行到10s时,△n(X)=0.79mol、△n(Y)=0.79mol、△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:X(g)+Y(g) ![]() 2Z(g),故答案为:X(g)+Y(g)
2Z(g),故答案为:X(g)+Y(g) ![]() 2Z(g);
2Z(g);
(3)反应的方程式为X(g)+Y(g) ![]() 2Z(g)。①混合气体的压强始终不变,不能说明达到平衡状态,故不选;②混合气体的密度始终不变,不能作平衡状态的标志,故不选;③混合气体的总物质的量始终不变,不能作平衡状态的标志,故不选;④反应物的消耗速率与生成物的消耗速率之比等于系数之比,说明正逆反应速率相等,能作平衡状态的标志,故选;⑤如何时候,各物质表示的反应速率之比等于化学计量数之比,不能作平衡状态的标志,故不选;
2Z(g)。①混合气体的压强始终不变,不能说明达到平衡状态,故不选;②混合气体的密度始终不变,不能作平衡状态的标志,故不选;③混合气体的总物质的量始终不变,不能作平衡状态的标志,故不选;④反应物的消耗速率与生成物的消耗速率之比等于系数之比,说明正逆反应速率相等,能作平衡状态的标志,故选;⑤如何时候,各物质表示的反应速率之比等于化学计量数之比,不能作平衡状态的标志,故不选;
⑥混合气体的质量和物质的量都不变,平均相对分子质量始终不变,不能作平衡状态的标志,故不选;故选④。


科目:高中化学 来源: 题型:
【题目】下列化学物质在生活、生产的运用描述不正确的是
A. 氢氧化钠能与二氧化硅反应,故常用氢氧化钠在玻璃上进行刻画
B. 工业上常用氨气来检查氯气管道是否泄漏
C. 氧化铝俗名刚玉,耐磨,常用于做轴承材料
D. 钠和鉀的合金呈液态,常做核反应堆的导热剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R最高价含氧酸的化学式为HaROb,则其最低价气态氢化物中R元素的化合价( )
A. 2b-a B. a-2b C. 8+a-2b D. 2b-a-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶液中加入新物质时, 其导电性(I)符合下图变化趋势的实验操作是
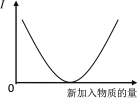
A. 乙酸溶液中通入氨气至过量
B. 石灰水中通入CO2至过量
C. 亚硫酸中通入氯气至过量
D. 氨水中通入氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种有机物:①硝基苯、②苯、③溴苯、④乙酸、⑤乙醇、⑥乙酸乙酯,其中难溶于水且比水轻的含氧有机物是
A. ②④⑥B. ①②③C. ⑤和⑥D. 只有⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明在恒温恒容下的密闭容器中,反应2SO2+O2![]() 2SO3,已达平衡状态的标志是
2SO3,已达平衡状态的标志是
A. SO2和SO3的物质的量浓度相等
B. 反应容器内气体的密度不随时间变化而变化
C. 单位时间内生成2mol SO3时,同时生成lmolO2
D. 容器中SO2、O2、SO3的物质的量之比为2:l:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5 g/100 mL。用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如下图所示:

![]()
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、_____________________________。
(2)应选用__________作为指示剂。达到滴定终点时,指示剂从____色变为_____色。
(3)某同学一共进行了三次实验。以下是他设计的实验数据记录表,表格中A是______________,B是_______________。
实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
A | B | 消耗体积(mL) | ||
1 | 20.00 | 22.05 | ||
2 | 20.00 | 21.34 | ||
3 | 20.00 | 21.30 | ||
数据处理:消耗标准NaOH溶液的体积=______________mL。
若测得稀释后白醋的浓度0.0594 mol/L,则该食醋______(选填“符合”、“不符合”)国家标准。
标准NaOH溶液通过以下步骤准备:①配制500 mL浓度约为0.1 mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度。
(4)称量所需的NaOH固体置于大烧杯中,加入500 mL蒸馏水,搅拌溶解,该配制步骤____________
(填“可行”或“不可行”)。
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现__________色和__________色交替的现象。
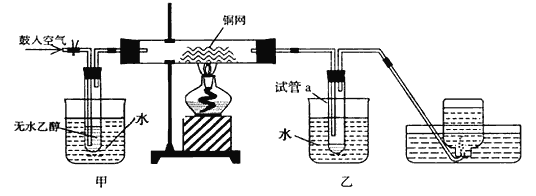
(2)甲和乙两个水浴作用不相同,其中甲中装的是热水,乙中装的是冷水。他们的作用依次为______________,________________。
(3)反应进行一段时间后,试管a中能 收集到若干种物质,其中一种液体能使紫色石蕊试纸显红色, 要除去该物质,可在混合液中加入_____________(填写字母)除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com