
【题目】某元素R最高价含氧酸的化学式为HaROb,则其最低价气态氢化物中R元素的化合价( )
A. 2b-a B. a-2b C. 8+a-2b D. 2b-a-8
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为_______。
(2)B、C、N三种元素第一电离能由小到大的顺序为________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3 | BCl3 | BBr3 | BI3 | |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是__________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)==NH4[BF4] (s)能够发生的原因:____________。
制备环硼氨烷的方法如下:
![]()
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________;与B3N3H6互为等电子体的分子的结构简式为________________。
(4)立方氮化硼的熔点为3000℃,其晶胞结构如图所示,晶胞参数a=361.5pm。
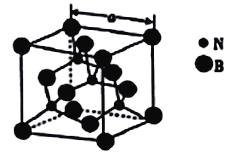
①立方氮化硼的晶体类型为_______________。
②紧邻的两个硼原子间的距离为_______(列出计算式即可) pm。
③立方氮化硼的密度为_____(列出计算式即可)g㎝-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物,商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取,己知:
乙酵 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
密度gcm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程:
![]()
(1)实验室焙烧紫菜,需要下列仪器中的___________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.蒸发皿 f.酒精灯 g.燃烧匙
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式___________。
(3)操作①的名称是__________;试剂A为_________ (填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:I_____________________;II __________________。
(4)操作②应在____________(仪器名称)中振荡、静置;观察到的现象是______________。
(5)该方案采用常压加热蒸馏并不合理,理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是_________。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式_______________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为_________。
Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)_________(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性。可用作医药、抗氧化剂以及制备次磷酸钠等。由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:

步骤1.在三口烧瓶中加入白磷和石灰乳,先通入N2,然后在约98°C下充分搅拌1h,同时收集产生的PH3。
步骤2.将反应液静置、过滤。
步骤3.向滤液中通入适量CO2,再过滤。
步骤4.用次磷酸溶液调节步骤3滤液的pH,浓缩、冷却结晶、干燥得次磷酸钙。
(1)步骤1先通入N2的目的是 ;搅拌的目的是 。
(2)步骤1石灰乳与 P4(白磷)发生反应的化学方程式为 ;步骤2过滤所得滤渣成分为 。
(3)步骤3的目的是 。
(4)请补充完整由产品进一步制备NaH2PO2·H2O的实验方案:取产品次磷酸钙加入烧杯中,加适量的水溶解, ,干燥得到NaH2PO2·H2O。(已知:在常压下,加热蒸发次磷酸钠溶液会发生爆炸,100℃时NaH2PO2·H2O的溶解度为667g/100g水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将等质量的Cu片、Zn片放入盛有1L稀硫酸溶液的烧杯中,用导线连接形成原电池。如下图所示:
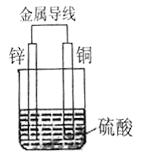
①原电池的负极材料是_____,(填“名称”)
铜片上发生反应的类型是_____反应(填“氧化”或“还原”)
②一段时间内,当电路中有2mol的电子发生转移时,理论上该装置中可收集气体___L(标准状况)
II. 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示
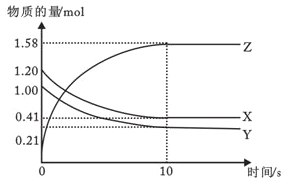
(1)反应从开始到10s时,用Y的浓度变化来表示的反应速率为__________
(2)该反应的化学方程式为:______________
(3)在恒温恒容的密闭容器中,当下列物理量不再发生变化时,一定可以作为上述反应达到平衡的标志是____________
①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④相同时间内,X消耗的物质的量与Z消耗的物质的量之比为1:2 ⑤各物质表示的反应速率之比等于化学计量数之比 ⑥混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计出一种装置(电解质溶液呈碱性),总反应为2CO2=2CO+O2。

(1)该装置实现了_______________(填“太阳能”“电能”“化学能”,下同)转化为_____________,最终转化为__________。
(2)x极发生了__________反应(填“氧化”或“还原”)Y极的电极反应:__________。
(3)反应完毕,该装置中的电解质溶液碱性__________ (填“增强”、“减弱”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A. N为正极,铁电极应与Y相连接
B. M电极反应式: CO(NH2)2+H2O-6e- = CO2↑+N2↑+6H+
C. 当N电极消耗0.25 mol气体时,则铁电极增重16 g
D. H十透过质子交换膜由右向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com