
����Ŀ���ߴ�������[��ѧʽ��Sr(NO3)2]���������źŵơ���ѧ�����ȡ�
��ҵ���������г���������ơ����ᱵ�����ʣ���������ƿ�����Ũ���ᣬ�������ȡ����ᱵ������Ũ���ᡣ�ᴿ�����ȵ�ʵ�鲽�����£�
��ȡ�����ʵ���������Ʒ�������м���ŨHNO3�ܽ⣬���衣
�ڹ��ˣ�����ŨHNO3ϴ��������
�۽���������ˮ�У����Թ�������ʹBa2+���������ú�����£�N2H4�����������ỹԭ������pH��7��8�����ˡ�
�ܽ���Һ���������pH��2��3������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӡ�
�ݽ��õ���Sr(NO3)2��2H2O������100 �������¸���õ��ߴ������ȡ�
��1���������ŨHNO3ϴ��������Ŀ����_________��
��2����������£�N2H4�����������ᣨCrO3����ԭΪCr3+��ͬʱ����һ����ɫ��ζ�����壬д���÷�Ӧ�����ӷ���ʽ_______________��
��3���¾��кܺõĻ�ԭ�ԣ���������������Ⱦ���ʿ����ڳ�ȥ��¯���豸��ˮ�е��ܽ����ȣ���ȥ100L��¯ˮ��������8g/L�����ܽ�������Ҫ�µ�����Ϊ_________��
��Sr(NO3)2�����ֽ⣬����Sr(NO2)2��O2����500 ��ʱSr(NO2)2��һ���ֽ�����SrO���������ȡһ��������Sr(NO2)2��Sr(NO3)2��Ʒ����������ȫ�ֽ⣬�õ�5.20 g SrO�����5.08 g������塣�������Ʒ��Sr(NO3)2������������д��������̣�_________����ȷ��0.01����
���𰸡� ��ȥ���ʼ��������ȵ��ܽ���ʧ 3N2H4 + 4CrO3+12H+=3N2��+ 4Cr3++12H2O 800g m(��Ʒ)= 5.20 g+5.08 g=10.28 g n(SrO)= ![]() =0.05 mol
=0.05 mol
n[Sr(NO3)2]��212 g��mol-1+ n[Sr(NO2)2]��180 g��mol-1=10.28 g
n[Sr(NO3)2]+ n[Sr(NO2)2] =0.05 mol
���:n[Sr(NO3)2] =0.04 mol (1��) n[Sr(NO2)2] =0.01 mol (1��)
w[Sr(NO3)2] = ![]() ��100%=82.49% (2 ��)
��100%=82.49% (2 ��)
����������1���������к�������ơ����ᱵ�����ʣ�������ƿ�����Ũ���ᣬ�������ȡ����ᱵ������Ũ���ᣬ����ȼ���Ũ���ᣬ�ܽ�����ƣ��ﵽ ��ȥ���ʼ��������ȵ��ܽ���ʧ��Ŀ����
��2���£�N2H4�����������ᣨCrO3����ԭΪCr3+��ͬʱ����N2����ϵ����غ㡢����غ㼰ԭ���غ�ô˷�Ӧ�����ӷ���ʽ3N2H4 + 4CrO3+12H+=3N2��+ 4Cr3++12H2O��
��3���³����ķ�Ӧ�����º���������Ϊ������������Ⱦ�������������ϳɵ�ˮ�����������غ㶨�ɿ�֪�����ﻹ�е������ٸ��ݹ۲취��ƽ�����Է���ʽ�ǣ�N2H4+O2=N2+2H2O����Ҫ�ܽ���������ʵ���Ϊ![]() =25mol������Ҫ�µ�����Ϊ25mol��32g/mol=800g��
=25mol������Ҫ�µ�����Ϊ25mol��32g/mol=800g��
��m����Ʒ��=5.20g+5.08g=10.28g��
n��SrO��=![]() =0.05mol��
=0.05mol��
n[Sr��NO3��2]��212gmol-1+n[Sr��NO2��2]��180gmol-1=10.28 g��
n[Sr��NO3��2]+n[Sr��NO2��2]=0.05mol��
��ã�n[Sr��NO3��2]=0.04mol��
n[Sr��NO2��2]=0.01mol��
��[Sr��NO3��2]= ![]() ��100%=82.49%��
��100%=82.49%��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ƥ��Ϊ���Ϳ�����ҩ�����ɱ���θ���Ĥ���ܸ������������ӵ�Σ������ϳ�·�����£�
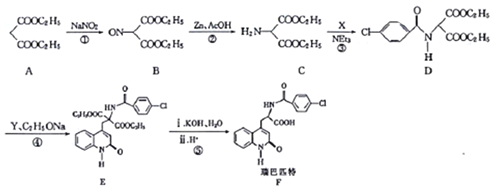
��֪��Y�Ľṹ��ʽΪ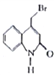
(1)A�Ļ�ѧ����Ϊ_______��A������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ___________��
(2)������C�й����ŵ�����Ϊ________��
(3)��Ӧ�ٵķ�Ӧ����Ϊ______����Ӧ�ڵķ�Ӧ����Ϊ__________��
(4)C��D��ת�������У����ɵ���һ�ֲ���ΪHCl����X�Ľṹ��ʽΪ__________��
(5)�����廯����Z��X��ͬ���칹�壬�ܷ���������Ӧ��Z�ĺ˴Ź�����������3��壬��Z�Ľṹ��ʽΪ______(��дһ��)��
(6)��֪����![]() HOCH2CH2CHO
HOCH2CH2CHO
��CH3CH2OH![]() CH3CH2Br��
CH3CH2Br��
��д����A��![]() Ϊԭ�ϣ����Լ���ѡ���Ʊ�
Ϊԭ�ϣ����Լ���ѡ���Ʊ�![]() �ĺϳ�·������ͼ____���ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ____���ϳ�·������ͼʾ�����£�
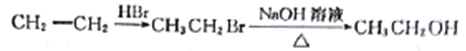
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.1 mol Na2CO3��ϡ���������õ����Ϊ1 L����Һ����Һ�в�������pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ����
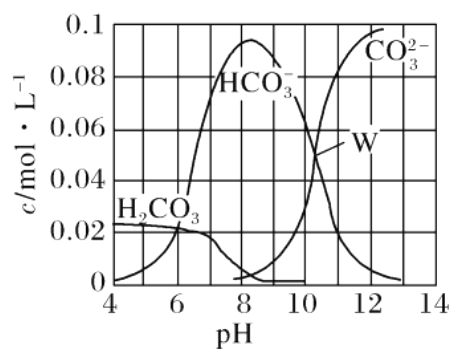
A. W����ʾ����Һ��c(Na��)>c(CO![]() )��c(HCO
)��c(HCO![]() )>c(OH��)>c(H��)
)>c(OH��)>c(H��)
B. pH��4����Һ��c(H2CO3)��c(HCO![]() )��c(CO
)��c(CO![]() )��0.1 mol��L��1
)��0.1 mol��L��1
C. ��pH��8����Һ��ͨ��CO2��pH��7���õ���Һ��c(Na��)>c(Cl��)��c(HCO![]() )��c(H2CO3)
)��c(H2CO3)
D. pH��11����Һ��c(Na��)��2c(H2CO3)>2c(Cl��)��2c(CO![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������400 mL 0.5 mol��L��1��NaOH��Һ���Իش��������⣺
��1�����㣺��ҪNaOH���������Ϊ______��
��2��ijѧ����������ƽ����һ��С�ձ�������������ǰ��������ڱ�ߵ���̶ȴ�����ƽ��ֹʱ���� ָ���ڷֶ��̵�ƫ��λ�ã���ʱ��ߵ����̽�______(��������������������)�ұߵ����̡���ʹ��ƽƽ�⣬�����еIJ���Ϊ_______���ٶ����ճƵ�С�ձ�������Ϊ______(����32.6 g������31.61 g��)��
��3�����Ʒ������������������裺
�� ��ʢ��NaOH���ձ��м���200 mL����ˮʹ���ܽ⣬����ȴ�����£�
�� ����������ƿ�м�����ˮ��Һ��ӽ��̶���1��2 cm����
�� ��NaOH��Һ�ز�����ע��500 mL����ƿ�У�
�� ���ձ��м�������������ˮ��С��ϴ��2��3�κ���������ƿ��
�� ���ý�ͷ�ιܼ�����ˮ���̶��ߣ��Ӹ�ҡ�ȡ�
�Խ����ϲ����ų��Ⱥ�˳��______��
��4��ijѧ��ʵ������NaOH��Һ��Ũ��Ϊ0.48 mol��L��1��ԭ�������______��
A��ʹ����ֽ�����������ƹ��� |
B������ƿ��ԭ��������������ˮ |
C���ܽ�NaOH���ձ�δ�����ϴ�� |
D����ͷ�ιܼ�ˮ����ʱ���ӿ̶� |
��5������������0.5 mol��L��1NaOH��Һ����ʾ��ͼ���д������(�����)______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A. �����£�PH��Ϊ9��CH3COONa��NaOH��Һ�У�ˮ�ĵ���̶Ȳ���ͬ
B. ��ӦNH3(g)+HCl(g)��NH4Cl(s)�������¿��Է����У���÷�Ӧ�Ħ�H��0
C. ��Ũ�Ⱦ�Ϊ0.1 mol��L��1��MgCl2��CuCl2�����Һ����μ��백ˮ���ȳ�����ɫ������˵��Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D. ��֪I![]()
![]() I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��R��ۺ�����Ļ�ѧʽΪHaROb��������ͼ���̬�⻯����RԪ�صĻ��ϼ�(����)
A. 2b-a B. a-2b C. 8+a-2b D. 2b-a-8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�м���������ʱ, �䵼���ԣ�I��������ͼ�仯���Ƶ�ʵ�������
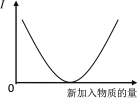
A. ������Һ��ͨ�백��������
B. ʯ��ˮ��ͨ��CO2������
C. ��������ͨ������������
D. ��ˮ��ͨ���Ȼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ�˵���ں��º����µ��ܱ������У���Ӧ2SO2+O2![]() 2SO3���Ѵ�ƽ��״̬�ı�־��
2SO3���Ѵ�ƽ��״̬�ı�־��
A. SO2��SO3�����ʵ���Ũ�����
B. ��Ӧ������������ܶȲ���ʱ��仯���仯
C. ��λʱ��������2mol SO3ʱ��ͬʱ����lmolO2
D. ������SO2��O2��SO3�����ʵ���֮��Ϊ2:l:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��ѧ��ָ�Ӽ�������������ƿ��еĻ�ѧ��Ӧ�������ܼ��ٶԻ����ĸ����á����л�ѧ��Ӧ��������ɫ��ѧ������ǣ� ��
A. �������᳧β���ŷţ�SO2+2NH3+H2O=(NH4)2SO3
B. ���������᳧�ĵ���������Ⱦ��NO2+NO+2NaOH=2NaNO2+H2O
C. ��CuSO4��Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
D. ��CuSO4��2Cu+O2 ![]() 2CuO��CuO+H2SO4(ϡ)=CuSO4+H2O
2CuO��CuO+H2SO4(ϡ)=CuSO4+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com