
【题目】(1)如图,若烧瓶是干燥的。当烧瓶口向上时,由A口导入气体,可收集下列中的____________(填序号,下同)气体。若烧瓶充满水,可收集下列中的________气体。
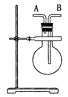
① NO ②NH3 ③SO2 ④ NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放置,由______口导入气体可收集NO气体,其原因是 ____________________________________________。
(3)实验室通常制备氨气的化学方程式 ______________________________ 。
【答案】② ① A NH3的密度小于NO Ca(OH)2+2NH4Cl![]() CaCl2 +2NH3↑+2H2O
CaCl2 +2NH3↑+2H2O
【解析】
(1)由A口导入气体,用该装置收集气体的依据,由于是集气瓶口向上,所以能够收集的气体密度必须大于空气且不能和空气的成分反应(这一点很少被提及),若烧瓶充满水,该装置收集气体的依据是能够不溶于水或与水不反应的气体;
(2)此时该装置收集气体的依据类似于排空法收集气体,从A口进,能够收集的气体密度必须大于氨气且不能和氨气反应;从B口进,能够收集的气体密度必须小于氨气且不能和氨气反应;
(3)实验室通常铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应。
(1)由A口导入气体,用该装置收集气体的依据,由于是集气瓶口向上,所以能够收集的气体密度必须小于空气且不能和空气的成分反应,而密度小于空气且不能和空气的成分反应的气体只有NH3;若烧瓶充满水,该装置收集气体的依据是能够不溶于水或与水不反应的气体,而不溶于水或与水不反应的气体只有NO,故答案为:②;①;
(2) 此时该装置收集气体的依据类似于排空法收集气体,从A口进,能够收集的气体密度必须大于氨气且不能和氨气反应,从B口进,能够收集的气体密度必须小于氨气且不能和氨气反应,故NH3的密度小于NO,可从A口进;
(3)实验室通常铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应,反应方程式为:Ca(OH)2+2NH4Cl![]() CaCl2 +2NH3↑+2H2O。
CaCl2 +2NH3↑+2H2O。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。

①电极X的材料是_________________;
②外电路中的电子是从___电极流向__电极(填电极材料名称或符号)。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是___________(填离子符号)。
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式:____________________。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用__________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的____极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+ Fe + 2H2O![]() Fe(OH)2+ Ni(OH)2。
Fe(OH)2+ Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是__(填序号)。
A.NiO2B.Fe C.Fe(OH)2D.Ni(OH)2
②该电池放电时,正极附近溶液的pH________(填增大、减小、不变)
③充电时该电池阳极的电极反应式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() H<0,将一定量的
H<0,将一定量的![]() 充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图
充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图![]() 气体颜色越深,透光率越小
气体颜色越深,透光率越小![]() 。下列说法正确的是
。下列说法正确的是
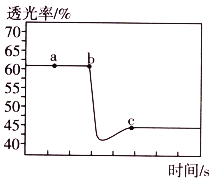
A.a点时化学反应速率为0
B.c点:υ正(NO2)>υ逆(NO2)
C.b点与c点相比,c(NO2)增大,c(N2O4)减小
D.若容器绝热,则平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:
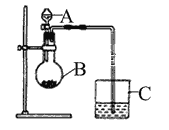
(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________,
②既存在离子键又存在极性键的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL某一元弱酸的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。

下列叙述正确的是( )
A.该弱酸在滴定前的浓度是0.15 mol/L
B.该弱酸稀释10倍后pH为4
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定过程为求滴定终点,最合适的指示剂是甲基橙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
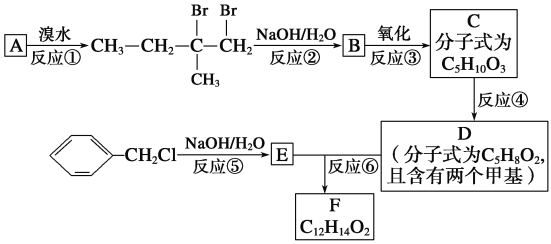
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;峰面积比为__________。
(2)上述合成路线中属于取代反应的是__________(填编号)。
(3)写出反应⑤、⑥的化学方程式:
⑤____________________________________________________________________;
⑥____________________________________________________________________。
(4)F有多种同分异构体,请写出符合下列条件的所有物质结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为—CH2COOCH3:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,研究和深度开发![]() 的应用对构建生态文明社会具有重要的意义。
的应用对构建生态文明社会具有重要的意义。

(1)![]() 是一种性能优良的光催化剂,能有效地将有机污染物转化为
是一种性能优良的光催化剂,能有效地将有机污染物转化为![]() 等小分子物质。图1为在
等小分子物质。图1为在![]() 的催化下,
的催化下,![]() 降解
降解![]() 的示意图,则该反应的化学方程式为____________________________。
的示意图,则该反应的化学方程式为____________________________。
(2)将一定量的![]() 和
和![]() 通入一恒容密闭容器中发生反应:
通入一恒容密闭容器中发生反应:![]() 。
。
![]() 化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧的相关热化学方程式如下:
化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧的相关热化学方程式如下:
![]()
![]()
则反应![]() 的
的![]() _______。
_______。
![]() 为了探究反应
为了探究反应![]() 的反应速率与浓度的关系,起始时向恒容密闭容器中通入
的反应速率与浓度的关系,起始时向恒容密闭容器中通入![]() 与
与![]() ,并使二者物质的量浓度均为
,并使二者物质的量浓度均为![]() ,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线
,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线![]() 如图
如图![]() :
:![]() 和
和![]() 。则与曲线
。则与曲线![]() 相对应的是图中曲线________
相对应的是图中曲线________![]() 填“甲”或“乙”
填“甲”或“乙”![]() ;该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________
;该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________![]() 填字母
填字母![]() 。
。
(3)用稀氨水喷雾捕集![]() 最终可得产品
最终可得产品![]() 。
。
![]() 在捕集时,气相中有中间体
在捕集时,气相中有中间体![]() 氨基甲酸铵
氨基甲酸铵![]() 生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:
生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:![]() 。实验测得的有关数据如下表
。实验测得的有关数据如下表![]() :
:

氨基甲酸铵的分解反应是________![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 反应。在
反应。在![]() ,此反应的化学平衡常数
,此反应的化学平衡常数![]() ________。
________。
![]() 在
在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() 。已知常温下
。已知常温下![]() 的电离平衡常数
的电离平衡常数![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在体积为2 L的密闭容器中,气态物质A、B、E、F的物质的量n随时间t的变化情况如图甲所示,在一定条件下反应达到平衡状态,反应进程中正反应速率随时间的变化情况如图乙所示,在t2、t4时刻分别只改变一个条件(温度、压强或某反应物的量)。下列说法错误的是( )
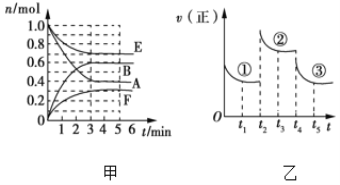
A. 此温度下,该反应的化学方程式为2A(g)+E(g)![]() 2B(g)+F(g)
2B(g)+F(g)
B. 若平衡状态①和②对应的温度相同,则①和②对应的平衡常数K一定相同
C. t2时刻改变的条件是增大压强
D. t4时刻改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2,A的核磁共振氢谱如图,峰面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是
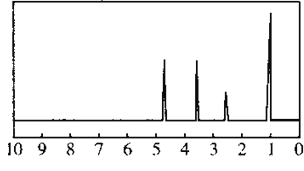
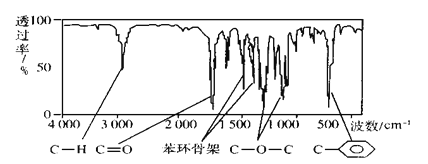
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与3mol H2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com