
【题目】(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。

①电极X的材料是_________________;
②外电路中的电子是从___电极流向__电极(填电极材料名称或符号)。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是___________(填离子符号)。
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式:____________________。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用__________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的____极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+ Fe + 2H2O![]() Fe(OH)2+ Ni(OH)2。
Fe(OH)2+ Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是__(填序号)。
A.NiO2B.Fe C.Fe(OH)2D.Ni(OH)2
②该电池放电时,正极附近溶液的pH________(填增大、减小、不变)
③充电时该电池阳极的电极反应式___________________________。
【答案】Cu 铜 银 Cl- O2+2H2O+4e-=4OH- C 负 A 增大 Ni(OH)2-2e-+2OH-=NiO2+2H2O
【解析】
(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,则Cu作负极,Ag作正极,故X电极材料为Cu;外电路电子由铜电极流向银电极;负极反应:Cu-2e-=Cu2+,故盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是Cl-;
(2)炒过菜的铁锅未及时清洗容易发生电化学腐蚀主要是吸氧腐蚀,铁作负极:2Fe—4e—=2Fe2+,C作正极:O2+2H2O+4e-=4OH-,为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,为牺牲阳极的阴极保护法,则焊接在铁闸门上的固体材料R的金属性强于铁,但不能与水反应,故只能选C项;丙所示方案也可以减缓铁闸门的腐蚀速率,为外接电源的阴极保护法,则铁闸门应连接直流电源的负极相接,作阴极;
(3)蓄电池反应原理NiO2+ Fe + 2H2O![]() Fe(OH)2+ Ni(OH)2可知放电时Fe作负极失电子被氧化:Fe—2e—+2 OH-=Fe(OH)2,NiO2得电子被还原发生还原反应;NiO2+2e-+2H2O= Ni(OH)2+2OH-,故正极附近溶液的pH增大;充电时该电池的正极做阳极电极反应式Ni(OH)2-2e-+2OH-=NiO2+2H2O。
Fe(OH)2+ Ni(OH)2可知放电时Fe作负极失电子被氧化:Fe—2e—+2 OH-=Fe(OH)2,NiO2得电子被还原发生还原反应;NiO2+2e-+2H2O= Ni(OH)2+2OH-,故正极附近溶液的pH增大;充电时该电池的正极做阳极电极反应式Ni(OH)2-2e-+2OH-=NiO2+2H2O。


科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下以下结论错误的是( )
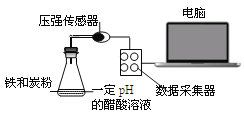
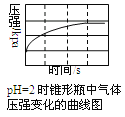
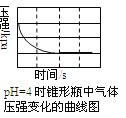
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁不可能发生吸氧腐蚀
C.吸氧腐蚀的速率比析氢腐蚀快
D.两溶液中负极反应均为:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A.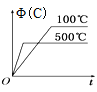 B.
B.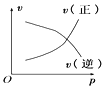 C.
C.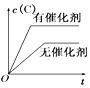 D.
D.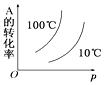
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G的合成路线如下:
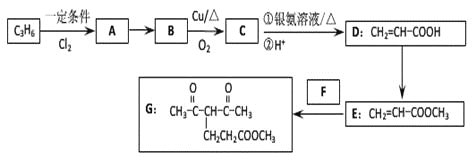
(1)D中含氧官能团的名称为_________,1 molG发生加成反应最多消耗_______mol H2 。
(2)去掉E中含有少量D的试剂和操作是________________________________________;下列有关E的说法正确的是_____________(填字母序号)。
A.可发生氧化反应 | B.催化条件下可发生缩聚反应 |
C.可发生取代反应 | D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式:________________________________________
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为______________________。
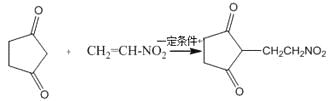
(5)比G少2个氢原子的物质具有下列性质:任写一种该物质的结构简式_________________。
①遇FeCl3溶液显紫色; ②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗2mol Na和1mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,

(1)达到平衡时,Y的浓度为_________________
(2)反应开始至2min,Z的平均反应速率为_____________
(3)该反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是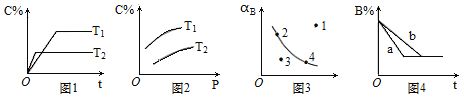
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率υ正<υ逆的是点1
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图,若烧瓶是干燥的。当烧瓶口向上时,由A口导入气体,可收集下列中的____________(填序号,下同)气体。若烧瓶充满水,可收集下列中的________气体。
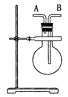
① NO ②NH3 ③SO2 ④ NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放置,由______口导入气体可收集NO气体,其原因是 ____________________________________________。
(3)实验室通常制备氨气的化学方程式 ______________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com