
【题目】某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,

(1)达到平衡时,Y的浓度为_________________
(2)反应开始至2min,Z的平均反应速率为_____________
(3)该反应的化学方程式为______________________________。
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途。
(1)已知:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
![]()
①平衡时,c(CH3OCH3)等于________ mol·L-1,反应混合物的总能量减少________ kJ。
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在下图中画出CH3OH的浓度的曲线示意图。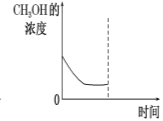
Ⅱ甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+ CO(g)![]() CH3OH(g)
CH3OH(g)
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
![]()
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”).
②按下列物质的量发生反应,CO的转化率由大到小的顺序是 (填甲乙丙).

(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)=2CO2(g)K2
③H2O(g)=H2O(l)K3
④CH3OH(l)+O2(g)=CO(g)+2H2O(l)K4
则K4= (用含有K1,K2,K3的代数式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
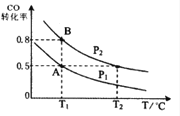
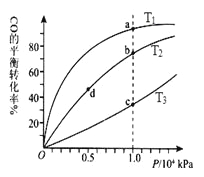
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为_________ 。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= ___ L。
(3)关于反应CO(g)+2H2(g)![]() CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2) D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g)![]() CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如上图所示。下列说法正确的是( ) 。
CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如上图所示。下列说法正确的是( ) 。
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) = K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流计的指针发生了偏转。
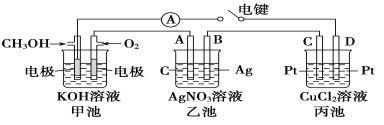
请回答下列问题:
(a)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为____mL(标准状况),丙池中______(填“C”或“D”)极析出_____g铜。
(b)若丙池中电极不变,将其中溶液换成NaCl溶液,开关闭合一段时间后,甲池中溶液的pH将____(填“增大”、“减小”或“不变”,下同);丙池中溶液的pH将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,价电子的电子排布式_________________,价电子所在电子层的轨道数______;
②LiBH4由Li+和BH4-构成,BH4-的空间构型是___________,B原子的杂化轨道类型是______;
③Li、B、Cl元素的电负性由大到小排列顺序为______________;
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:

M是_______(填元素符号);
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞边长a=480pm,Na+半径为104pm,H-的半径________pm,NaH的理论密度是_______________gcm-3。(用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质或原子结构的递变,叙述不正确的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次增大
C. N、O、F得电子能力依次减弱
D. LiOH、NaOH、KOH的碱性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中的化学叙述不正确的是( )
A.无法用米汤(含淀粉)检验加碘盐中的碘酸钾(KIO3)
B.用聚乙烯制造的塑料薄膜可用于包装食品
C.蚕丝、羊毛、棉花的主要成分都是蛋白质
D.75℅的酒精可用于医用消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H7Cl的有机物,其结构不可能是( )
A. 只有一个双键的直链有机物 B. 含有两个双键的直链有机物
C. 含有一个双键的环状有机物 D. 含有一个三键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将![]() 氧化成
氧化成![]() ,而稀硝酸不能氧化
,而稀硝酸不能氧化![]() 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与![]() 反应,能与
反应,能与![]() 反应
反应
![]()
(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论一局的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是 (选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com