
某化学小组的同学到实验室学习。在实验桌上摆有如图所示仪器:
(1)指导教师要求同学们写出仪器的名称,某同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则此空不需要填写)。
| 仪器编号 | a | b | c | d | e |
| 名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
| 改正的名称 | | | | | |

科目:高中化学 来源: 题型:单选题
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未发生水解 |
| D | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列与实验相关的叙述中,正确的是 ( )
| A.将碘水倒入分液漏斗,再加适量苯,充分振荡、静置、过滤,可从碘水中获取碘 |
| B.从CuSO4溶液得到CuSO4·5H2O的操作是加热浓缩,冷却结晶 、过滤、洗涤、干燥 |
| C.室温下向滴有酚酞的NaOH溶液中滴加稀盐酸当红色恰好退去时所得溶液pH=7 |
| D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量浓度的溶液的专用仪器 ②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热 ④不能用容量瓶贮存配制好的溶液
⑤一定要用500mL容量瓶配制250mL溶液
| A.①③ | B.①②④ | C.①②④⑤ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关化学实验的说法中正确的是
| A.烧杯、坩埚、试管、锥形瓶都可以用酒精灯直接加热 |
| B.银镜反应、乙醛与新制Cu(OH)2反应、实验室制取乙烯都必须用水浴加热 |
| C.制取氨气、氢气时都可以用向下排空气法收集 |
| D.石油的分馏、实验室制取乙炔和制取蒸馏水都要用到冷凝装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)(1)下列有关实验操作或判断不正确的是 。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B.用干燥的pH试纸测定氯水的pH |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
| | 试剂 | 离子反应方程式 |
| ①NaHCO3溶液(Na2CO3) | | |
| ② Fe2O3(Al2O3) | | |
| ③FeCl3溶液(FeCl2) | | |
| ④CO2(HCl) | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用18mol/L的硫酸配制100 mL 1.0 mol/L的硫酸,若实验仪器有:A、100mL量筒;B、托盘天平;C、玻璃棒;D、50 mL容量瓶;E、10 mL量筒;F、胶头滴管;G、50 mL烧杯;H、100 mL容量瓶。
(1)实验时选用的仪器是________;(填仪器序号)
(2)在容量瓶的使用方法中,下列操作不正确的是( )
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心的倒入容量瓶中,加入蒸馏水到接近刻度线2—3cm处,再用滴管滴加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2—3cm处,再用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动几次
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体。通过下述实验确定该晶体的组成:
①称取0.1680g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.02000mol·L-1KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL。
②接着将溶液充分加热,使浅紫红色变为蓝色,此时MnO—4转化为Mn2+并释放出O2。
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀。
④用0.05000mol·L-1Na2S2O3溶液滴定,近终点加指示剂,滴定至终点,消耗10.00mL。
已知:2MnO—4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O
2Cu2++4I—=2CuI↓+I2
2Na2S2O3+I2=2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中加入的指示剂为 。
(3)通过计算写出蓝色晶体的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组甲欲用KMnO4测定FeSO4的含量。
(1)①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液200 mL,配制时需要的仪器除天平、药匙外,还需要的仪器有_____、_____、_____、_____、_____。
②用KMnO4(酸化)滴定时,含硫酸亚铁的溶液放在_____(填仪器)中,高锰酸钾溶液放在______(填仪器)中,滴定终点时溶液的颜色为_____色。
(2)另一研究小组乙设计了如下测量方案: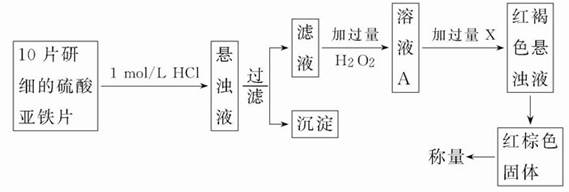
①过滤时用到的玻璃仪器有________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有_____(按操作的顺序填写)。
A过滤;B洗涤;C萃取;D分液;E冷却;F灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com