
【题目】完成下列各小题。
(1)铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等。
①写出赤铁矿主要成分的化学式___________________;
②红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其化学反应方程式为_______;
(2)写出除去下列气体中的杂质(括号内的气体为杂质)所用的试剂,并写出除杂的化学方程式。
CO2 (HCl) ______________;化学方程式:_________________。
(3)1774年,瑞典化学家舍勒在研究软锰矿的过程中,制备出了一种黄绿色、有刺激性气味的气体。舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。写出实验室制取氯气的化学方程式__________________。
【答案】 ![]() 3Fe+4H2O(g)
3Fe+4H2O(g) ![]() Fe3O4+4H2 饱和NaHCO3溶液 NaHCO3+HCl
Fe3O4+4H2 饱和NaHCO3溶液 NaHCO3+HCl![]() NaCl+H2O+CO2↑ MnO2 + 4HCl(浓)
NaCl+H2O+CO2↑ MnO2 + 4HCl(浓) ![]() MnCl2 +2H2O +Cl2 ↑
MnCl2 +2H2O +Cl2 ↑
【解析】(1)赤铁矿的主要成分为氧化铁;铁与水蒸气反应生成四氧化三铁和氢气;
(2)根据除杂的原则可知,应该选择一种能够与氯化氢反应,而不能与二氧化碳反应的物质分析;
(3)实验室是通过加热二氧化锰和浓盐酸的混合物制备氯气的。
(1)①赤铁矿的主要成分为氧化铁,故答案为:Fe2O3;
②红热的铁能跟水蒸气反应,生成气体为氢气,还生成四氧化三铁,反应为3Fe+4H2O(气)![]() Fe3O4+4H2,故答案为:3Fe+4H2O(气)
Fe3O4+4H2,故答案为:3Fe+4H2O(气)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)除去CO2 (HCl)应该选用饱和的碳酸氢钠溶液,发生的化学方程式为NaHCO3+HCl![]() NaCl+H2O+CO2↑,故答案为:饱和NaHCO3溶液;NaHCO3+HCl
NaCl+H2O+CO2↑,故答案为:饱和NaHCO3溶液;NaHCO3+HCl![]() NaCl+H2O+CO2↑;
NaCl+H2O+CO2↑;
(3) 实验室通过加热二氧化锰和浓盐酸的混合物制备氯气,反应的化学方程式为MnO2 + 4HCl(浓) ![]() MnCl2 +2H2O +Cl2 ↑,故答案为:MnO2 + 4HCl(浓)
MnCl2 +2H2O +Cl2 ↑,故答案为:MnO2 + 4HCl(浓) ![]() MnCl2 +2H2O +Cl2 ↑。
MnCl2 +2H2O +Cl2 ↑。


科目:高中化学 来源: 题型:
【题目】下列物质的分类组合全部正确的是
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | 氯化钠 | 水 | 氯气 |
B | 硫酸 | 碳酸钙 | 四氯化碳 |
C | 氯化银 | HD | 蔗糖 |
D | 氢氧化钡 | 次氯酸 | 乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的MgSO4溶液时,下列情况可能导致实际浓度偏高的是( )
A.称量时部分MgSO4吸收了水蒸气
B.定容时俯视容量瓶上的刻度线
C.洗涤后的容量瓶中有少量水珠
D.溶解过程中有少量的溶液溅出烧杯外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )
选 项 | A | B | C | D |
物 质 | Na2O2 | H2O | HCl | NaCl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B. 放电时电池内部Li+向负极移动
C. 充电过程中,电池正极材料的质量增加
D. 可加入硫酸以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g)![]() S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
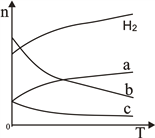
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为____________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是以空气、海水中的物质为原料制取纯碱的工业流程:
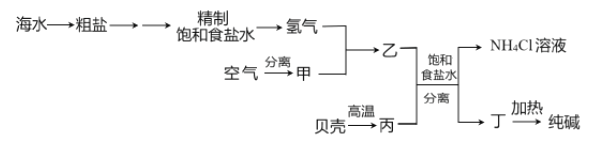
已知粗盐中含有Ca2+、Mg2+、SO42-等杂质离子。下列有关说法不正确的是
A. 除去粗盐中的杂质离子可依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液
B. 甲、丙分别为N2、CO2
C. 分离得到丁和NH4Cl溶液的操作是过滤
D. 上述流程中物质转化有涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1L0.5mol/L碳酸钠溶液中含有的CO32-离子数为0.5NA
B. 5.6gFe与稀硝酸完全反应,转移的电子数可能为0.2NA
C. 3.2g甲醇中的羟基所含电子数为NA
D. 密闭容器中1molN2与3molH2充分反应,产物分子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com