
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1L0.5mol/L碳酸钠溶液中含有的CO32-离子数为0.5NA
B. 5.6gFe与稀硝酸完全反应,转移的电子数可能为0.2NA
C. 3.2g甲醇中的羟基所含电子数为NA
D. 密闭容器中1molN2与3molH2充分反应,产物分子数为2NA
【答案】B
【解析】A,n(Na2CO3)=0.5mol/L![]() 1L=0.5mol,在溶液中由于CO32-的水解,CO32-物质的量小于0.5mol,A项错误;B,n(Fe)=
1L=0.5mol,在溶液中由于CO32-的水解,CO32-物质的量小于0.5mol,A项错误;B,n(Fe)=![]() =0.1mol,若发生反应3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,反应中转移0.2mol电子,若发生反应Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,反应中转移0.3mol电子,若生成Fe(NO3)2和Fe(NO3)3,转移电子数介于0.2mol~0.3mol,B项正确;C,n(CH3OH)=
=0.1mol,若发生反应3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,反应中转移0.2mol电子,若发生反应Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,反应中转移0.3mol电子,若生成Fe(NO3)2和Fe(NO3)3,转移电子数介于0.2mol~0.3mol,B项正确;C,n(CH3OH)=![]() =0.1mol,含羟基0.1mol,0.1mol羟基中所含电子物质的量为0.9mol,C项错误;D,N2与H2合成NH3为可逆反应,则1molN2与3molH2充分反应生成的NH3物质的量小于2mol,D项错误;答案选B。
=0.1mol,含羟基0.1mol,0.1mol羟基中所含电子物质的量为0.9mol,C项错误;D,N2与H2合成NH3为可逆反应,则1molN2与3molH2充分反应生成的NH3物质的量小于2mol,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】完成下列各小题。
(1)铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等。
①写出赤铁矿主要成分的化学式___________________;
②红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其化学反应方程式为_______;
(2)写出除去下列气体中的杂质(括号内的气体为杂质)所用的试剂,并写出除杂的化学方程式。
CO2 (HCl) ______________;化学方程式:_________________。
(3)1774年,瑞典化学家舍勒在研究软锰矿的过程中,制备出了一种黄绿色、有刺激性气味的气体。舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。写出实验室制取氯气的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2B 在水溶液中存在下列关系:H2B=H++HB-,HB-![]() H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
A. 电离方程式:NaHB=Na++H++B2-
B. NaHB 溶液可能呈酸性或碱性
C. NaHB 和NaOH 溶液反应的离子方程式:HB-+OH-= H2O+B2-
D. 该溶液中:c(Na+)=c(H2B)+c(HB-)+c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是
A | B | C | D |
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”。 | 属青铜制品,是我国古代科技光辉成就的代表之一。 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱。 | 属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在一定体积pH = 12的NaOH溶液中, 加入一定体积0.01 mol/L的NaHSO4溶液,此时混合溶液的pH = 11。若反应后溶液的体积等于NaOH 溶液与NaHSO4溶液的体积之和,则NaOH溶液与NaHSO4溶液的体积比是( )
A. 1∶9 B. 10∶1 C. 11∶9 D. 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
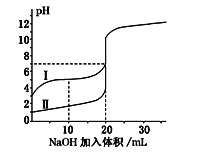
A. Ⅰ表示的是滴定盐酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C. V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面说法中,与盐类水解无关的是( )
①NaHCO3做发酵粉时加入柠檬酸后效果更好
②FeCl2溶液中加入一定量的铁粉
③实验室配制AlCl3溶液,先把它溶解在盐酸中,而后加水稀释
④NH4F溶液不能保存在玻璃试剂瓶中
⑤实验室盛放Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入镁条会产生气泡
⑦Na2S溶液和AlCl3溶液反应得不到Al2S3
⑧室温下NaHCO3饱和溶液pH约为8.4
⑨0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L
A. ②⑧ B. ①② C. ④⑧ D. 全有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
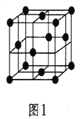
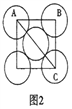
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某风景区被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2﹣就是一种空气负离子,其摩尔质量为( )
A.32g
B.33g
C.32gmol﹣1
D.33gmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com