
| 实验 编号 | HA物质的量 | NaOH物质的量 | 混合溶液 |
| 浓度(mol?L-1) | 浓度(mol?L-1) | 的pH | |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |


科目:高中化学 来源: 题型:
| A、向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度 |
| B、NH3是一种碱,能使湿润的红色石蕊试纸变蓝 |
| C、少量的CO2通入BaCl2溶液中会产生白色沉淀 |
| D、SO2能使酸性高锰酸钾溶液褪色,是因为SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
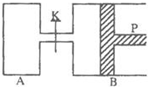 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com