

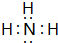 ;非金属性O>N,故稳定性:NH3<H2O,
;非金属性O>N,故稳定性:NH3<H2O, ;<;
;<;
| ||
| △ |
| ||
| △ |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
| A、高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 |
| B、人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C、大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨 |
| D、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
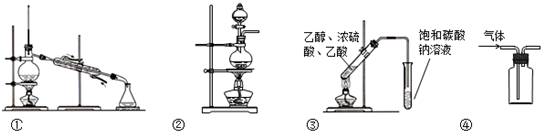
| A、装置①常用于分离互不相溶的液体 |
| B、装置②可用于实验室加热酒精与浓硫酸的混合物制取乙烯 |
| C、装置③可用于制备乙酸乙酯 |
| D、装置④可用于收集NO、CO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.
前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | HA物质的量 | NaOH物质的量 | 混合溶液 |
| 浓度(mol?L-1) | 浓度(mol?L-1) | 的pH | |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
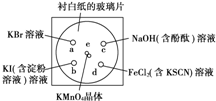 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol?L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,各种液滴彼此分开,围成半径小于表面皿的圆形(如图所示)在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com