
【题目】质子核磁共振谱(PMR)是研究有机物结构的有力手段之一。在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号)。谱中峰的强度与结构中的H原子数成正比。例如:乙醛的结构式为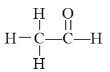 ,其中PMR谱中有2个信号峰,其强度之比为3∶1。
,其中PMR谱中有2个信号峰,其强度之比为3∶1。
(1)分子式为C3H6O2的二元混合物,若在PMR谱上观察到氢原子给出的峰有两种情况。第一种情况峰的强度之比为3∶3;第二种情况峰的强度之比为3∶2∶1。由此推断可能组成该混合物的各物质是(写结构简式):__________________、__________、_______________;
(2)在测得的PMR谱上可观察到化合物![]() 有3个峰,而CH3CH=CHCl化合物却得到氢原子给出的6个信号峰。根据原子在空间的排列方式的不同,写出CH3CH=CHCl分子的空间异构体:_____________________________________。
有3个峰,而CH3CH=CHCl化合物却得到氢原子给出的6个信号峰。根据原子在空间的排列方式的不同,写出CH3CH=CHCl分子的空间异构体:_____________________________________。
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)某同学依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示:
①负极发生的电极反应为___________;
②电解质溶液中的NO3-向__________电极移动;(写出电极材料的名称)
(2)当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是________;
(3)水是生命之源,也是化学反应中的主角。请回答下列问题:
已知:2mol H2完全燃烧生成液态水时放出572 kJ的热量。
①若2mol氢气完全燃烧生成水蒸气,则放出的热量______(填“>”“<”或“=”)572 kJ;
②每克氢气燃烧生成液态水时放出的热量为________;
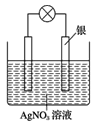
(4)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。
a电极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.葡萄糖、果糖和蔗糖都能发生水解反应
B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物
D.油脂是食物组成中的重要部分,也是产生能量最高的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡前,化学反应速率:2v (NH3)=3v (H2O)
B. 若单位时间内生成x mol NO,同时消耗x mol NH3,则反应达到化学平衡状态
C. 达到化学平衡状态时,若增大容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡状态时,4v正(O2)=5v逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2![]() N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
A. 平均反应速率A>B
B. 平衡时NO2的物质的量B>A
C. 平衡时NO2的转化率A>B
D. 平衡时N2O4的物质的量B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
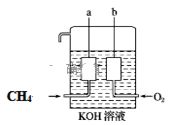
【题目】氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题:
(1)氮分子的电子式为______________________。
(2)图中属于“氮的固定”的是___________(填字母)。
(3)已知NH4Cl溶液呈酸性,用离子方程式解释原因___________________________________________ 。
(4)用离子方程式举一例表示循环中发生非氧化还原反应的过程__________________。
(5)若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂物质的量之比为____________。
(6)若反应i是在酸性条件下由NO3—与Fe2+的作用实现,则该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]、硫氰[(SCN)2]等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2=2Fe(SCN)3、Ag++CN-= AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2=2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (OCN)2+H2O=2H++OCN-+OCNO-
D. MnO2+4HSCN![]() Mn(SCN)2+ (SCN)2↑+2H2O
Mn(SCN)2+ (SCN)2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com