
【题目】下列说法正确的是
A.有些活泼金属如铝可作还原剂法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列关于NO的说法正确的是( )
A.NO是红棕色气体
B.常温下氮气与氧气反应可生成NO
C.NO溶于水可以生成硝酸
D.NO是汽车尾气的有毒成分之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下:
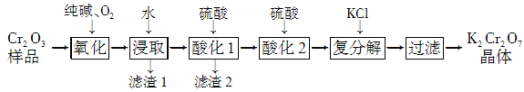
已知:2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(1) 上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是________。
(2) 酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol·L-1,需调节溶液pH的范围是________。
已知:Al(OH)3(s) ![]() H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是_________________。
(4) 称取重铬酸钾试样2.40 g 配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-===2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学反应方程式
(1)在25℃, 101kPa下, 23g乙醇完全燃烧生成CO2和液态水时放热321.4kJ。则表示乙醇燃烧热的热化学方程式为_____________;
(2)室温下,稀H2SO4和稀KOH溶液发生中和反应,对应的中和热的热离子方程式为_____________;
(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5mol电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为(要求C2H2的系数为1) _____________;
(4) 在25℃, 101kPa下,已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则2mol NH3完全分解生成N2与H2时,对应的热化学方程式为_____________;
(5) 己知:C(石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599.2kJ/mol,
计算25℃时,由C(石墨)和H2(g)反应生成1molC2H2(g)的△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表一部分,列出了十个元素在周期表中的位置:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | |||||||
3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ④ | ⑨ |
请用化学用语回答下列问题
(1)在①~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),⑤所对应元素的单质工业制备方法为 。
(3)用电子式表示元素③与⑧形成化合物的过程 。
(4)我国首创以单质⑤—空气—海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极反应是 ,正极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1molFe溶于过量稀硝酸,电子转移数为2NA
B.标准状况下,2.24LCCl4含有分子的数目为0.1NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________
(2)反应②中的能量变化如图所示,该反应为 (吸或放)热反应,ΔH2=________。(用E1、E2表示)
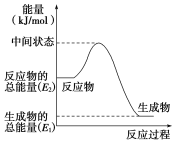
(3)H2(g)的燃烧热为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种离子晶体的晶胞如图其中阳离子A以![]() ,表示阴离子B以
,表示阴离子B以![]() 表示。
表示。
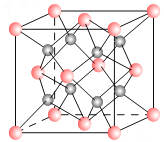
(1)若A和B的核外电子排布与Ar相同,则该离子化合物的化学式是 ___________________;
(2)阳离子周围距离最近的阴离子数为___ __,阴离子周围距离最近的阴离子数___ __。
(3)若与MgO的熔点比较,出现不同的原因是
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com