
分析 已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-572kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2598kJ•mol-1
根据盖斯定律,①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:C(s,石墨)+H2(g)=C2H2(g),反应热也进行相应的计算.
解答 解:由①C(s,石墨)+O2(g)=CO2(g)△H1=-393kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-572kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2598kJ•mol-1
根据盖斯定律,①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:C(s,石墨)+H2(g)=C2H2(g),故△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3=+227 kJ/mol,
故答案为:+227 kJ/mol.
点评 本题考查根据盖斯定律进行反应热的计算,难度不大,关键是由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式.


科目:高中化学 来源: 题型:解答题
 (加聚反应)
(加聚反应) (取代反应)
(取代反应) (取代反应)
(取代反应) ;若
;若 若在上述类似条件下发生反应,请写出反应的方程式
若在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既可以通过复分解反应又可以通过化合反应生成Fe(OH)3 | |
| B. | SO2、SiO2、CO均为酸性氧化物 | |
| C. | 强电解质的导电性一定大于弱电解质的导电性 | |
| D. | 同种元素组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钡难溶于水,故硫酸钡为弱电解质 | |
| B. | 石墨虽能导电,但不是电解质,而是非电解质 | |
| C. | 反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| D. | 所有的放热反应都能在常温常压下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为Ag2S | B. | 银针验毒时,空气中氧气得到电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | 每生成1mo1X,反应转移2mo1 e- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
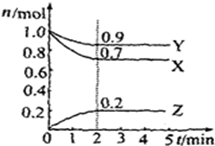 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com