
【题目】实验室欲配制100mL 2mol/L的NaCl溶液,请回答:
(1)配制时所需固体NaCl物质的量为____________mol,NaCl物质的质量为____________g。
(2)配制过程中需要用到的仪器有:药匙、托盘天平和砝码、烧杯、玻璃杯、____________、胶头滴管。
(3)定容的正确操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加蒸馏水至____________为止。
(4)容量瓶上标有温度、刻度线、____________。
【答案】0.2 11.7 100mL的容量瓶 凹液面与刻度线相切 容量
【解析】
配制100mL 2mol/L的NaCl溶液,先计算NaCl的物质的量,再求出NaCl的质量,用天平称取,在烧杯中溶解,冷却后转移到100mL的容量瓶中,洗涤玻璃棒和烧杯一同转移到容量瓶,摇动,加蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加蒸馏水至凹液面与刻度线相切为止,摇匀。
(1)配制100mL 2mol/L的NaCl溶液,所需固体NaCl的物质的量为:![]() 所需NaCl固体的质量为:
所需NaCl固体的质量为:![]() ,故答案为:0.2;11.7。
,故答案为:0.2;11.7。
(2)配制过程中需要用到的仪器有:药匙、托盘天平和砝码、烧杯、玻璃杯、胶头滴管,还需要100mL的容量瓶,故答案为:100mL的容量瓶。
(3)定容的正确操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加蒸馏水至凹液面与刻度线相切为止,故答案为:凹液面与刻度线相切。
(4)容量瓶是精密仪器,标有温度、刻度线和容量,故答案为:容量。


科目:高中化学 来源: 题型:
【题目】(1)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
![]()
若A 是一种淡黄色固体单质.则C与H2O反应的生成物为______(填化学式)。
(2)Na2O2也是一种淡黄色固体,Na2O2与CO2反应生成O2和_______(填化学式)。
(3)写出在催化剂作用下N2与H2合成氨的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在2L的密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为______。
②若X、Y、Z均为气体,2min时反应达到平衡,此时体系内压强与开始时的压强之比为____。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时__(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的说法中不正确的是( )
A.6.02×1023叫做阿伏加德罗常数
B.12g12C含有的碳原子数就是阿伏加德罗常数的值
C.含有阿伏加德罗常数值个微粒的物质是1mol
D.1.5molH2O含有9.03×1023个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +3、+5、 |
|
下列叙述正确的是
A.X、Y的单质与稀盐酸反应速率X<Y
B.一定条件下,W单质可以将Z从其氢化物中置换出来
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.常温下,Z单质与W的常见单质直接生成ZW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
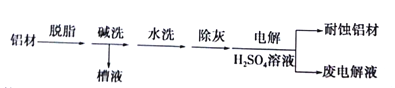
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列中的______。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(2)以铝材为阳极,在![]() 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
取少量废电解液,加入![]() 溶液后产生气泡和白色沉淀,产生沉淀的原因是______(用化学用语回答)
溶液后产生气泡和白色沉淀,产生沉淀的原因是______(用化学用语回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2![]() N2O4(正反应为放热反应) B. C(s)+CO2
N2O4(正反应为放热反应) B. C(s)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
C. N2+3H2![]() 2NH3(正反应为放热反应) D. H2S
2NH3(正反应为放热反应) D. H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com