
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +3、+5、 |
|
下列叙述正确的是
A.X、Y的单质与稀盐酸反应速率X<Y
B.一定条件下,W单质可以将Z从其氢化物中置换出来
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.常温下,Z单质与W的常见单质直接生成ZW2
【答案】B
【解析】
W的主要化合物只有-2价,没有正价,所以W为O;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为N元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素。
A.Mg比Al活泼,若与同浓度的稀盐酸反应Mg的反应速率快,若盐酸浓度不同则无法确定,故A错误;
B.O的非金属性比N强,则O2的氧化性强于N2,所以可以从NH3中置换出N2,故B正确;
C.氨水的碱性较弱,不能与Al(OH)3反应,故C错误;
D.常温下O2与N2不反应,故D错误;
故答案为B。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】2018年7月12日,我国科学家姜雪峰教授被评为”全球青年化学家元素周期表硫元素代言人”,其是目前为止第一位人选的中国学者。下列说法或推测正确的是
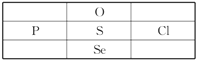
A. 单质S不溶于水,微溶于酒精,易溶于二硫化碳
B. 含氧酸的酸性:Cl>S>P
C. 沸点:H2O<H2S<PH3
D. 由H和S形成共价键的过程: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下:![]() (g)
(g)![]()
 (g)+H2(g) △H=+17.6kJ/mol
(g)+H2(g) △H=+17.6kJ/mol
(1)在刚性容器中要提高乙苯平衡转化率,可采取的措施有______
(2)实际生产中往刚性容器中同时通入乙苯和水蒸气,测得容器总压和乙苯转化率随时间变化结果如图所示。
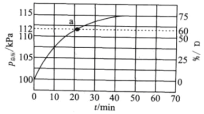
①平衡时,p(H2O)=_____kPa,平衡常数Kp=_____kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的![]() ______。
______。
(3)O2气氛下乙苯催化脱氢同可时存在以下两种途径:
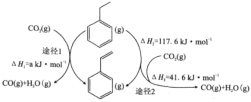
①a=________。
②途径I的反应历程如图所示,下列说法正确的是_____
a.CO2为氧化剂 b.状态1到状态2形成了O-H键
c.中间产物只有(![]() ) d.该催化剂可提高乙苯的平衡转化率
) d.该催化剂可提高乙苯的平衡转化率
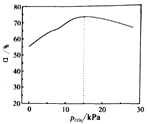
③pCO2与乙苯平衡转化率关系如图分析,pCO2为15kPa时乙苯平衡转化率最高的原因______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示,下列有关说法不正确的是
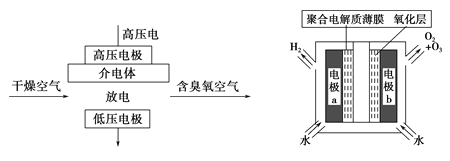
A. 高压放电法,反应的原理为3O2![]() 2O3
2O3
B. 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C. 电解时,![]() 由电极
由电极![]() 经聚合固体电解质膜流向电极
经聚合固体电解质膜流向电极![]()
D. 电解时,电极![]() 周围发生的电极反应有
周围发生的电极反应有![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制100mL 2mol/L的NaCl溶液,请回答:
(1)配制时所需固体NaCl物质的量为____________mol,NaCl物质的质量为____________g。
(2)配制过程中需要用到的仪器有:药匙、托盘天平和砝码、烧杯、玻璃杯、____________、胶头滴管。
(3)定容的正确操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加蒸馏水至____________为止。
(4)容量瓶上标有温度、刻度线、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述
中,正确的是

A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.气态氢化物的稳定性W的比X的强
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为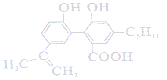 ,下列说法正确的是( )
,下列说法正确的是( )
A. 1 mol该有机物最多可以与7 mol H2发生加成反应
B. 该有机物可以发生取代、加成、氧化、水解等反应
C. 0.1 mol该有机物与足量金属钠反应最多可以生成3.36L H2
D. 与该有机物具有相同官能团的同分异构体共有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。
![]()
A物质所含官能团的名称是________。
(2)反应③的化学方程式是____________________________________________。
(3)下列物质中,不能通过乙烯加成反应得到的是________(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄可用于酿酒。检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是________________________________________。
(5)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是_______。
②实验开始时,试管b中的导管不伸入液面下的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲酸是原子利用率高的反应,且生成的甲酸是重要化工原料。下列说法不正确的是( )

A. 二氧化碳的电子式: ![]()
B. 在捕获过程,二氧化碳分子中的共价键完全断裂
C. N(C2H5)3能够协助二氧化碳到达催化剂表面
D. CO2催化加氢合成甲酸的总反应式:H2+CO2=HCOOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com