
【题目】2018年7月12日,我国科学家姜雪峰教授被评为”全球青年化学家元素周期表硫元素代言人”,其是目前为止第一位人选的中国学者。下列说法或推测正确的是
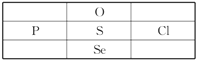
A. 单质S不溶于水,微溶于酒精,易溶于二硫化碳
B. 含氧酸的酸性:Cl>S>P
C. 沸点:H2O<H2S<PH3
D. 由H和S形成共价键的过程: ![]()
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】按要求作答:
(1)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式____________________________
(2)写出难溶电解质Mg(OH)2的溶度积表达式: Ksp=________;在Mg(OH)2悬浊液中加入FeCl3固体充分振荡后静置,发生沉淀的转化过程可用离子方程式表示为________。
(3)通过煤的干馏可以获得化工原料苯。苯与浓硝酸在催化剂条件下进行反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡贝地尔(  )是多巴胺能激动剂,合成路线如下:
)是多巴胺能激动剂,合成路线如下:
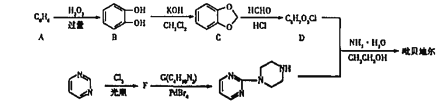
已知:①![]()
②D的结构简式为![]()
(1)A的名称是__________。
(2)E→F的反应类型是__________。
(3)G的结构简式为________;1molB最多消耗NaOH与Na的物质的量之比为_______。
(4)D+H→吡贝地尔的反应的化学方程式为_______。
(5)D的同分异构体中满足下列条件的有______种(碳碳双键上的碳原子不能连羟基),其中核磁共振氢谱有5种峰且峰面积之比为2:2:1:1:1的结构简式为_______(写出一种即可)。①与FeCl3溶液发生显色反应②苯环上有3个取代基③1mol该同分异构体最多消耗3molNaOH。
(6)已知:![]() ;参照上述合成路线,以苯和硝基苯为原料(无机试剂任选)合成
;参照上述合成路线,以苯和硝基苯为原料(无机试剂任选)合成![]() ,设计制备的合成路线:_______。
,设计制备的合成路线:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,萘可与浓硝酸、浓硫酸两种混酸反应生成二硝基化合物,它是1,5-二硝基萘和1,8-二硝基萘的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这二种物质分离。在上述硝化产物中加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是
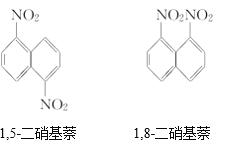
A. 对所得的滤液蒸发浓缩冷却结晶
B. 向滤液中缓缓加入水后过滤
C. 将滤液缓缓加入水中后过滤
D. 向滤液中缓缓加入Na2CO3溶液后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学习小组设计了如下图所示的实验方案:
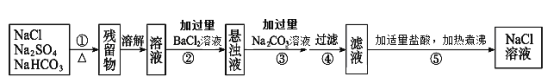
回答下列问题:
(1)操作①加热过程中,发生反应的化学方程式是_______。
(2)操作②不用Ba(NO3)2溶液的理由是:__________。
(3)进行操作②中,判断“BaCl2溶液是否过量”的方法是:_________。
(4)操作③“加入过量Na2CO3溶液”的目的是:________。
(5)操作⑤中“加适量盐酸”的主要目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)200mL2mol/L的Al2(SO4)3溶液中SO42-的物质的量浓度为___;
(2)标准状况下,36gH2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为___;
(3)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为___;
(4)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
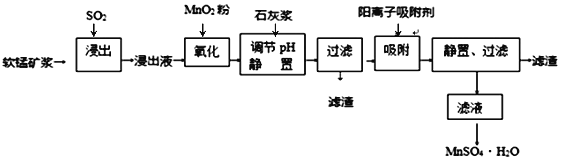
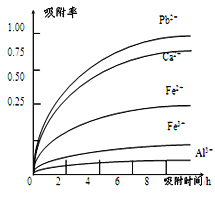
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。

(1)浸出过程中生成Mn2+反应的化学方程式为_________________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式___________________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有__________________________等(写二点)。
(5)吸附步骤除去的主要离子为_________________。
(6)电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_____。
(7)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +3、+5、 |
|
下列叙述正确的是
A.X、Y的单质与稀盐酸反应速率X<Y
B.一定条件下,W单质可以将Z从其氢化物中置换出来
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.常温下,Z单质与W的常见单质直接生成ZW2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com