
【题目】用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(1)已知:2SO2(g)+ O2(g)![]() 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+ O2(g)![]() 2NO2 (g) △H2
2NO2 (g) △H2
NO2 (g) + SO2(g)![]() SO3(g) + NO(g) △H3
SO3(g) + NO(g) △H3
则△H3 =__________(用△H1、△H2表示),如果上述三个反应方程式的平衡常数分别为K1、 K2、K3,则K3 =__________(用K1、K2表示)。
(2)如图所示,A 是恒容的密闭容器,B 是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2mol NO 和1 mol O2通过K1、K3分别充入A、B 中,发生的反应为2NO(g)+ O2(g)![]() 2NO2 (g) [不考虑2NO2 (g)
2NO2 (g) [不考虑2NO2 (g)![]() N2 O4 (g) ],起始时A、B 的体积相同均为a L。
N2 O4 (g) ],起始时A、B 的体积相同均为a L。
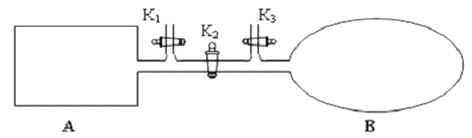
①下列说法和示意图正确,且既能说明A 容器中反应达到平衡状态,又能说明B 容器中反应达到平衡状态的是_________。
a. A、B 容器中气体的颜色均不再发生变化
b. A、B 容器中NO 和O2物质的量浓度比均为2:1

② T℃时,A 容器中反应达到平衡时的平衡常数Kp = 8×10﹣2 (kPa)﹣1。若A 容器中反应达到平衡时p(NO2) = 200kPa,则平衡时NO的转化率为_____________。(Kp 是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如 图实线 所示。
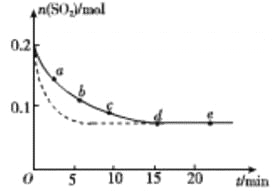
编号 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab 段平均反应速率____________(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为_________________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如图中虚线所示,则改变的条件是__________。
【答案】(△H1—△H2)/2 ![]() ac 66.7% 大于 0 加入催化剂
ac 66.7% 大于 0 加入催化剂
【解析】
(1)已知:①2SO2(g)+ O2(g)![]() 2SO3(g) △H1,②2NO(g)+ O2(g)
2SO3(g) △H1,②2NO(g)+ O2(g)![]() 2NO2 (g) △H2,③NO2 (g) + SO2(g)
2NO2 (g) △H2,③NO2 (g) + SO2(g)![]() SO3(g) + NO(g) △H3,则根据盖斯定律可知(①-②)÷2即得到反应③,所以其反应热△H3 =(△H1—△H2)/2,如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3 =
SO3(g) + NO(g) △H3,则根据盖斯定律可知(①-②)÷2即得到反应③,所以其反应热△H3 =(△H1—△H2)/2,如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3 =![]() 。
。
(2)①a、颜色的深浅与浓度有关系,所以A、B 容器中气体的颜色均不再发生变化说明二氧化氮的浓度不再发生变化,反应达到平衡状态,a正确;b、根据方程式可知NO 和O2始终按照物质的量之比2:1进行,所以A、B 容器中NO 和O2物质的量浓度比始终均为2:1,不能说明反应达到平衡状态,b错误;c、当逆反应速率不再发生变化时说明反应达到平衡状态,c正确;d、平衡常数只与温度有关系,不能说明反应是否达到平衡状态,d错误,答案选ac。
② 2NO(g)+ O2(g)![]() 2NO2 (g)
2NO2 (g)
起始量(mol) 2 1 0
转化量(mol) 2x x 2x
平衡量(mol)2-2x 1-x 2x
则200=![]() ,氧气和NO的分压分别是
,氧气和NO的分压分别是![]() 、
、![]() ,因此根据平衡常数可知
,因此根据平衡常数可知
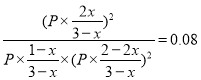 ,解得x=2/3,所以平衡时NO的转化率为
,解得x=2/3,所以平衡时NO的转化率为![]() 。
。
(3)①根据图像可知ab段的曲线效率大,所以平均反应速率大于bc段平均反应速率:根据图像可判断de 段浓度不再发生变化,反应达到平衡状态,则de段的平均反应速率为0。
②仅改变某一个实验条件, 测得SO2的物质的量随时间变化如图中虚线所示,此时达到平衡的时间减少,但平衡状态不变,所以改变的条件是加入催化剂。
【点晴】
该题考查的知识点较多,属于中等难度试题。难点和易错点是平衡状态判断、平衡常数应用、图像分析。可逆反应达到平衡状态有两个核心的判断依据:①正反应速率和逆反应速率相等。②反应混合物中各组成成分的百分含量保持不变。只要抓住这两个特征就可确定反应是否达到平衡状态,对于随反应的发生而发生变化的物理量如果不变了,即说明可逆反应达到了平衡状态。判断化学反应是否达到平衡状态,关键是看给定的条件能否推出参与反应的任一物质的物质的量不再发生变化。有关图像分析答题时需要注意:(1)紧扣特征,弄清可逆反应的正反应是吸热还是放热,体积增大、减小还是不变,有无固体、纯液体物质参与反应等。
(2)先拐先平,在含量(转化率)—时间曲线中,先出现拐点的则先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。
(3)定一议二,当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。
(4)三步分析法,一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁络合物[(NH2CH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如下:

已知:
甘氨酸(NH2CH2COOH ) | 异抗坏血酸 | 甘氨酸亚铁 | FeSO4.7H2O | FeCl2.4H2O |
易溶入水 | 易溶于水和乙醇 | 易溶于水 | 易溶于水 | 易溶于水 |
微溶于乙醇 | 有弱酸性和强氧化性 | 难溶于乙醇 | 难溶于乙醇 | 易溶于乙醇 |
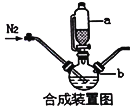
请回答:
(1)合成装置中仪器b的名称是____________
(2)合成过程中,为了防止亚铁被氧化,本实验中采取的措施是____________
(3)下列说法正确的是____________
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ、步骤Ⅳ都有固液分离,可采用常压过滤,也可采用减压过滤
D.粗产品提纯操作为重结晶,过滤,洗涤,干燥,其中干燥过程最好选用真空干燥
(4)合成过程需控制pH=5.5,pH过低或过高都会使产率下降,试说明理由_________________
(5)步骤Ⅲ加入无水乙醇的目的是___________________________________________________
(6)产品纯度可用“凯氏定氮法”测定,测定过程分为以下四步:
I、将有机氮转换为硫酸铵 II、将铵盐转化为氨气蒸出
III、用试剂吸收氨气 IV、滴定
①以下装置可以完成II,III两步操作
②将下列操作按合理顺序排入:
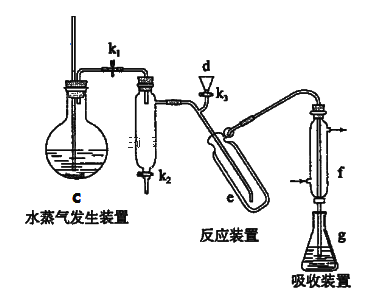
仪器清洗后,在g中加入吸收剂,然后将第I步获得的铵盐试样由d注入e→(_________)→(_________)→(_________)→(_________)→使水蒸气进入e,蒸馏几分钟后,将f下端提离液面并用少量蒸馏水洗涤清洗管口,停止加热c ,移去锥形瓶,立即用标准盐酸溶液进行滴定。
A.打开k1 B.关闭k3、k2 C.加热c D.由d注入氢氧化钠溶液,蒸馏水冲洗,并留少量液体作水封
②关于滴定过程下列说法正确的是____________
A.滴定管必须经检漏、洗涤、润洗后才能使用
B.标准盐酸溶液装入滴定管后,发现下端有气泡,可将橡皮管稍向上弯曲,挤压玻璃珠,气泡可被流水带出
C.滴定刚开始时,左手可以离开旋塞,让溶液自然流下
D.因为本测定方法较为精密和准确而操作过程繁琐,故产品纯度测定一次就可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚![]() 重整制取
重整制取![]() ,具有无毒、无刺激性等优点。回答下列问题:
,具有无毒、无刺激性等优点。回答下列问题:
![]() 和
和![]() 发生反应I:
发生反应I:![]()
已知:![]()
![]()
![]()
![]()
![]()
![]() 则反应I的
则反应I的![]() ____________
____________ ![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
![]() 保持温度和压强不变,分别按不同进料比通入
保持温度和压强不变,分别按不同进料比通入![]() 和
和![]() ,发生反应I。测得平衡时
,发生反应I。测得平衡时![]() 的体积百分含量与进料气中
的体积百分含量与进料气中![]() 的关系如图a所示。当
的关系如图a所示。当![]() 时,
时,![]() 的体积百分含量快速降低,其主要原因是____________
的体积百分含量快速降低,其主要原因是____________ ![]() 填标号
填标号![]() 。
。
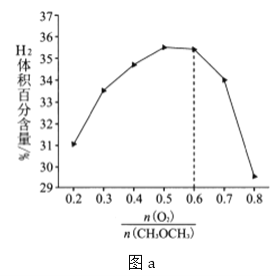
A 过量的![]() 起稀释作用
起稀释作用
B 过量的![]() 与
与![]() 发生副反应生成
发生副反应生成![]()
C ![]() 平衡向逆反应方向移动
平衡向逆反应方向移动
![]() 时,在恒容密闭容器中通入
时,在恒容密闭容器中通入![]() ,发生反应II:
,发生反应II:![]()
![]()
![]() ,测得容器内初始压强为
,测得容器内初始压强为![]() ,反应过程中反应速率
,反应过程中反应速率![]() 、时间t与
、时间t与![]() 分压
分压![]() 的关系如图b所示。
的关系如图b所示。
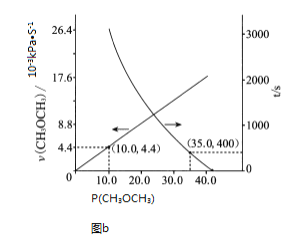
![]() 时,
时,![]() 的转化率为____________
的转化率为____________ ![]() 保留2位有效数字
保留2位有效数字![]() ;反应速率满足
;反应速率满足![]() ,
,![]() ____________
____________ ![]() ;
;![]() 时
时![]() ____________
____________ ![]() 。
。
![]() 达到平衡时,测得体系的总压强
达到平衡时,测得体系的总压强![]() ,则该反应的平衡常数
,则该反应的平衡常数![]() __________
__________![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是____________,其理由是____________。
该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是____________,其理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成纤维、合成橡胶、合成塑料、合成乙醇![]() 酒精
酒精![]() 的基本化工原料,也用于制造氯乙烯、苯乙烯、环氧乙烷、醋酸、乙醛、乙醇和炸药等。世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。工业上常采用烷烃裂解的方法制备乙烯。回答下列问题:
的基本化工原料,也用于制造氯乙烯、苯乙烯、环氧乙烷、醋酸、乙醛、乙醇和炸药等。世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。工业上常采用烷烃裂解的方法制备乙烯。回答下列问题:
![]() 已知
已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() 、
、![]() 、
、![]() 。利用乙烷制备乙烯的化学方程式
。利用乙烷制备乙烯的化学方程式![]()
![]() 。
。
![]() ________
________![]() 。
。
![]() 一定温度下,将
一定温度下,将![]() 加入固定体积的密闭容器中发生上述反应,下列能够表示到达平衡状态有________
加入固定体积的密闭容器中发生上述反应,下列能够表示到达平衡状态有________![]() 填字母
填字母![]() 。
。
A ![]()
![]() 气体压强不再变化
气体压强不再变化
C 气体的密度不再变化 D ![]() 的体积分数不再变化
的体积分数不再变化
![]() 在某密闭容器中通入
在某密闭容器中通入![]() ,正丁烷
,正丁烷![]() ,在不同条件下发生反应
,在不同条件下发生反应![]() ,正丁烷
,正丁烷![]() ,测得平衡时
,测得平衡时![]() 的体积分数
的体积分数![]() 与温度、压强的关系如图所示。
与温度、压强的关系如图所示。
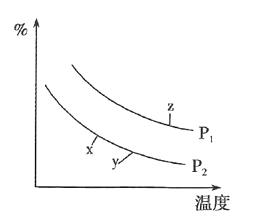
![]() ________
________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,欲提高乙烯的产率,下列措施可行的是________。
,欲提高乙烯的产率,下列措施可行的是________。
A 加压升温 ![]() 加压降温
加压降温
C 减压降温 ![]() 减压升温
减压升温
E.选择优质催化剂
![]() 、y、z三点的化学平衡常数大小关系为________。
、y、z三点的化学平衡常数大小关系为________。
![]() 若z点对应的纵坐标的数值为50,此时
若z点对应的纵坐标的数值为50,此时![]() 的转化率为________,该条件下的化学平衡常数
的转化率为________,该条件下的化学平衡常数![]() ________
________![]() 用含有
用含有![]() 的表达式表示,
的表达式表示,![]() 为以分压表示的平衡常数
为以分压表示的平衡常数![]() 。
。
![]() 最近,中科院研究将甲烷在催化作用下脱氢后发生偶联反应生成乙烯,反应原理为:
最近,中科院研究将甲烷在催化作用下脱氢后发生偶联反应生成乙烯,反应原理为:![]() ,反应同时存在副反应:
,反应同时存在副反应:![]() ,实验测得产物的体积分数受温度影响变化如图所示,制取乙烯应控制的反应温度为________
,实验测得产物的体积分数受温度影响变化如图所示,制取乙烯应控制的反应温度为________![]() ,温度过高,乙烯的体积分数反而减少的主要原因是________。
,温度过高,乙烯的体积分数反而减少的主要原因是________。
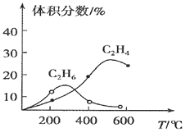
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示。

(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图甲表示可逆反应A(g)+2B(g)2C(g),速率随外界条件的改变曲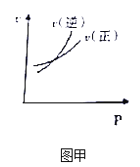
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化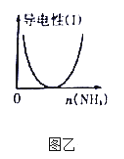
C. 图丙表示用0.1mol/L NaOH溶液滴定20.00mL 0.1mol/LCH3COOH溶液得到的滴定曲线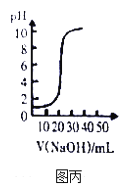
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g)相同时间后测得NO2含量的曲线,则该反应的△H<0 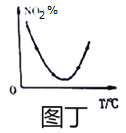
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(有机化学基础选做题)下列关系正确的是
A.沸点:乙二醇>丙三醇
B.与钠反应的快慢:CH3CH2COOH>苯酚>水>乙醇
C.等质量的有机物完全燃烧的耗氧量:甲烷>乙烯>乙炔>苯
D.同物质的量的物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com