
����Ŀ��������![]() ������ȡ
������ȡ![]() �����������̼��Ե��ŵ㡣�ش��������⣺
�����������̼��Ե��ŵ㡣�ش��������⣺
![]() ��
��![]() ������ӦI��
������ӦI��![]()
��֪��![]()
![]()
![]()
![]()
![]()
![]() ��ӦI��
��ӦI��![]() ____________
____________ ![]() �ú�
�ú�![]() ��
��![]() ��
��![]() �Ĵ���ʽ��ʾ
�Ĵ���ʽ��ʾ![]() ��
��
![]() �����¶Ⱥ�ѹǿ���䣬�ֱ𰴲�ͬ���ϱ�ͨ��
�����¶Ⱥ�ѹǿ���䣬�ֱ𰴲�ͬ���ϱ�ͨ��![]() ��
��![]() ��������ӦI�����ƽ��ʱ
��������ӦI�����ƽ��ʱ![]() ������ٷֺ������������
������ٷֺ������������![]() �Ĺ�ϵ��ͼa��ʾ����
�Ĺ�ϵ��ͼa��ʾ����![]() ʱ��
ʱ��![]() ������ٷֺ������ٽ��ͣ�����Ҫԭ����____________
������ٷֺ������ٽ��ͣ�����Ҫԭ����____________ ![]() ����
����![]() ��
��
A ������![]() ��ϡ������
��ϡ������
B ������![]() ��
��![]() ��������Ӧ����
��������Ӧ����![]()
C ![]() ƽ�����淴Ӧ�����ƶ�
ƽ�����淴Ӧ�����ƶ�
![]() ʱ���ں����ܱ�������ͨ��
ʱ���ں����ܱ�������ͨ��![]() ��������ӦII��
��������ӦII��![]()
![]()
![]() ����������ڳ�ʼѹǿΪ
����������ڳ�ʼѹǿΪ![]() ����Ӧ�����з�Ӧ����
����Ӧ�����з�Ӧ����![]() ��ʱ��t��
��ʱ��t��![]() ��ѹ
��ѹ![]() �Ĺ�ϵ��ͼb��ʾ��
�Ĺ�ϵ��ͼb��ʾ��
![]() ʱ��
ʱ��![]() ��ת����Ϊ____________
��ת����Ϊ____________ ![]() ����2λ��Ч����
����2λ��Ч����![]() ����Ӧ��������
����Ӧ��������![]() ��
��![]() ____________
____________ ![]() ��
��![]() ʱ
ʱ![]() ____________
____________ ![]() ��
��
![]() �ﵽƽ��ʱ�������ϵ����ѹǿ
�ﵽƽ��ʱ�������ϵ����ѹǿ![]() ����÷�Ӧ��ƽ�ⳣ��
����÷�Ӧ��ƽ�ⳣ��![]() __________
__________![]() ��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ
��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ![]() ��ѹ
��ѹ![]() ���ʵ�������
���ʵ�������![]() ��
��
![]() ���¶��£�Ҫ���̴ﵽƽ�������ʱ�䣬���Ľ������⣬���ɲ�ȡ�Ĵ�ʩ��____________����������____________��
���¶��£�Ҫ���̴ﵽƽ�������ʱ�䣬���Ľ������⣬���ɲ�ȡ�Ĵ�ʩ��____________����������____________��
���𰸡�![]()
![]()
![]()
![]() ��
��![]()
![]() ��
��![]()
![]() ����Ӧ���ѹǿ ����ѹǿ����ѧ��Ӧ���ʼӿ�
����Ӧ���ѹǿ ����ѹǿ����ѧ��Ӧ���ʼӿ�
��������
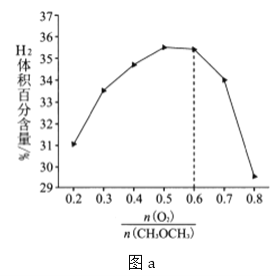
��1������֪������CH3OCH3��g��CO��g��+H2��g��+CH4��g����H1
��![]()
��![]()
��˹���ɼ����+��-2����õ�![]()
�ڵ�![]() >0.6ʱ��H2������ٷֺ������ٽ��͵�ԭ����������������������˷�Ӧ��
>0.6ʱ��H2������ٷֺ������ٽ��͵�ԭ����������������������˷�Ӧ��
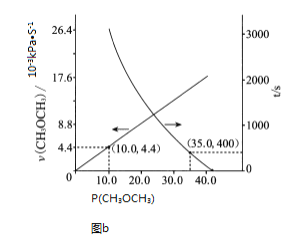
��2����t=400sʱ��CH3OCH3��ѹP��CH3OCH3��=35.0KPa����������ڳ�ʼѹǿΪ41.6kPa��ת����=![]() ��100%=
��100%=![]() ��100%����Ӧ��������v��CH3OCH3��=kPn��CH3OCH3����k=
��100%����Ӧ��������v��CH3OCH3��=kPn��CH3OCH3����k=![]() ��400sʱP��CH3OCH3��=��=35.0KPa��v��CH3OCH3��=kPn��CH3OCH3����
��400sʱP��CH3OCH3��=��=35.0KPa��v��CH3OCH3��=kPn��CH3OCH3����
�ڴﵽƽ��ʱ�������ϵ����ѹǿP��=121.6kPa��������м���õ����ʵ�������÷�Ӧ��ƽ�ⳣ��Kp=![]() ��
��
�۸��¶��£�Ҫ���̴ﵽƽ�������ʱ�䣬���Ľ������⣬��������Ӧ���ѹǿ������Ӧ���Ũ�ȵȡ�
![]() ��֪��
��֪��![]()
![]()
![]()
��˹���ɼ���![]() �õ�
�õ�![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ͼ���������
ͼ���������![]() ʱ��
ʱ��![]() ������ٷֺ������ٽ��͵�ԭ������ǣ�������
������ٷֺ������ٽ��͵�ԭ������ǣ�������![]() ��
��![]() ��������Ӧ����
��������Ӧ����![]() ����ѡB��
����ѡB��
![]() sʱ��
sʱ��![]() ��ѹ
��ѹ![]() ����������ڳ�ʼѹǿΪ
����������ڳ�ʼѹǿΪ![]() kPa��ת����
kPa��ת����![]() ����Ӧ��������
����Ӧ��������![]() ��
��![]() ����һ��ֱ�ߣ���
����һ��ֱ�ߣ���![]() ��
��![]() ��400sʱ
��400sʱ![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��![]() ��
��
![]() �ﵽƽ��ʱ�������ϵ����ѹǿ
�ﵽƽ��ʱ�������ϵ����ѹǿ![]() ����Ϊ����1��������壬����3��������壬�����ӵ���������Ϊ��Ӧ���ɵ�����������壬��ƽ��ʱ��
����Ϊ����1��������壬����3��������壬�����ӵ���������Ϊ��Ӧ���ɵ�����������壬��ƽ��ʱ��![]() ����ƽ��ʱ
����ƽ��ʱ![]() ��ƽ�ⳣ��
��ƽ�ⳣ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ���¶��£�Ҫ���̴ﵽƽ�������ʱ�䣬���Ľ������⣬����������Ӧ���ѹǿ������Ӧ���Ũ�ȣ���߷�Ӧ��ѹǿ����ѧ��Ӧ���ʼӿ죬
���¶��£�Ҫ���̴ﵽƽ�������ʱ�䣬���Ľ������⣬����������Ӧ���ѹǿ������Ӧ���Ũ�ȣ���߷�Ӧ��ѹǿ����ѧ��Ӧ���ʼӿ죬
�ʴ�Ϊ������Ӧ���ѹǿ������ѹǿ����ѧ��Ӧ���ʼӿ졣


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��Һ�����п��ܺ���Fe3+��Al3+��Fe2+��Mg2+��Cu2+��NH4����K+��CO32����SO42����Br�� �����ӵļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й�������ͼ��ʾ��
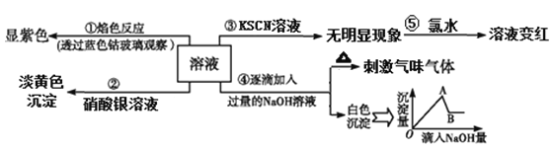
���������ͼ�ƶϣ�
��1��ʵ��١�����ȷ��ԭ��Һ��һ������________��_______(�����ӷ��ţ���
��2��ʵ��������������������ԭ�����ӷ���ʽΪ__________________________________��
��3��ʵ����в����Ĵ̼�����ζ�����壬���˳����ø����ʵ�Ũ��Һ��������ܵ��Ƿ�©������Ӧ�Ļ�ѧ����ʽ��_______________________________________________
��4��д��ʵ����У���A��B��������������Ӧ�����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о����ְ�����Ϣ���У�![]() (2��4-����-1-��ϩ)��
(2��4-����-1-��ϩ)��![]() (3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
(3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
A��2��4-����1��ϩ�ķ���ʽΪC9H18
B��2��4-����-1-��ϩ��3��7-����-1-��ϩ��Ϊͬϵ��
C������������Ϣ�ؾ���ʹ������Ȼ�̼��Һ��ɫ
D��1 mol�Ҳϵ�����Ϣ����1 mol Br2�ӳɣ�����ֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĸ�װ�õ�˵������ʵ��Ҫ����ǣ� ��
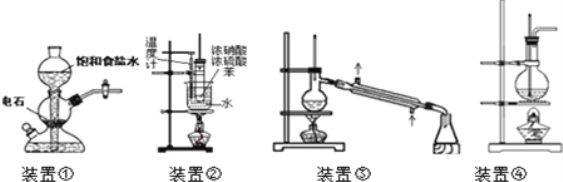
A.װ�â٣�ʵ�����������Ʊ��϶�������Ȳ���ô�װ��
B.װ�âڣ�ʵ�����п��ô�װ�����Ʊ��������������������NO2���Ի�ɫ
C.װ�âۣ�ʵ������ֱ������ҽ�þƾ��Ʊ���ˮ�ƾ�
D.װ�âܣ�ʵ�����п��ô�װ�����Ʊ���������������ƿ�л�ò���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��������Ҫ���������壬ͨ��
��������Ҫ���������壬ͨ��![]() ��
��![]() ��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
![]() ʱ�������Ͻ�Ϊ��������
ʱ�������Ͻ�Ϊ��������![]() ������ͨ��
������ͨ��![]() ��
��![]() ���������·�Ӧ��
���������·�Ӧ��![]() ��ƽ����ϵ�и��������������±���
��ƽ����ϵ�и��������������±���
���� |
|
| CO |
|
������� |
|
|
|
|
![]() ���¶��¸÷�Ӧ��ƽ�ⳣ��
���¶��¸÷�Ӧ��ƽ�ⳣ��![]() __________
__________
![]() ��֪��
��֪��![]()
![]()
![]()
![]()
![]()
��Ӧ![]() ��
��![]() _____________
_____________![]()
![]() �Զ������ѱ��渲��
�Զ������ѱ��渲��![]() Ϊ���������Խ�
Ϊ���������Խ�![]() ��
��![]() ֱ��ת�������ᡣ
ֱ��ת�������ᡣ
![]() �ڲ�ͬ�¶��´����Ĵ�Ч�������������������ͼ��ʾ��
�ڲ�ͬ�¶��´����Ĵ�Ч�������������������ͼ��ʾ��![]() ʱ���¶����߶�������������ʽ��͵�ԭ����___________��
ʱ���¶����߶�������������ʽ��͵�ԭ����___________��
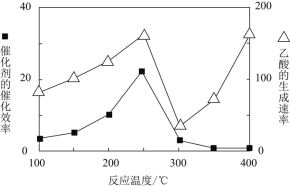
![]() Ϊ����߸÷�Ӧ��
Ϊ����߸÷�Ӧ��![]() ��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_________��
��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_________��
![]() ��
��![]() ��MgO��������
��MgO��������![]() ��
��
![]() ���Ѱ������
���Ѱ������![]() ���������ʣ����н��鲻��������______
���������ʣ����н��鲻��������______
![]() ���ھ���ǿ�����Ե�������Ѱ��
���ھ���ǿ�����Ե�������Ѱ��
![]() ���ڼ�����������Ѱ��
���ڼ�����������Ѱ��
![]() ���ڢ�A����A��Ԫ���γɵ���������Ѱ��
���ڢ�A����A��Ԫ���γɵ���������Ѱ��
![]() ����
����![]() �������ںϳ�
�������ںϳ�![]() ��
��![]() �������ա��ͷ�
�������ա��ͷ�![]() ��ԭ���ǣ���
��ԭ���ǣ���![]() ��
��![]() ��
��![]() �Ӵ�������
�Ӵ�������![]() ��ƽ��������
��ƽ��������![]() ����Ӧ������У��ų�
����Ӧ������У��ų�![]() ��
��![]() ������˵����ԭ���Ļ�ѧ����ʽ��_____________��
������˵����ԭ���Ļ�ѧ����ʽ��_____________��
![]() ���µ�⼼���ܸ�Чʵ�����з�Ӧ��
���µ�⼼���ܸ�Чʵ�����з�Ӧ��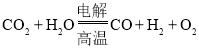 ����ɽ��ͷŵ�
����ɽ��ͷŵ�![]() ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ������ԭ��ʾ��ͼ���£�
ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ������ԭ��ʾ��ͼ���£�
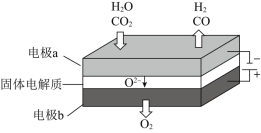
![]() �ڵ缫a�ŵ�ĵ缫��Ӧʽ��____________��
�ڵ缫a�ŵ�ĵ缫��Ӧʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�ͭ��(Cu2S)Ϊԭ��ұ��ͭ���䷴Ӧԭ���ɱ�ʾΪCu2S��O2![]() 2Cu��SO2������˵������ȷ����( )
2Cu��SO2������˵������ȷ����( )
A.���ϼ۷����仯��Ԫ����3��
B.Cu2S�ڸ÷�Ӧ�м������������ǻ�ԭ��
C.1 mol O2�μӷ�Ӧʱ��������Ӧת�Ƶ��������ʵ���Ϊ4 mol
D.SO2�����롢���պ���������SO3����Ϊ��ȡ�����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S�ڽ������ӵļ���������ú��������������ҪӦ�á���ش�
��.��ҵ��һ���Ʊ�H2S�ķ������ڴ��������������£�����Ȼ����SO2��Ӧ��ͬʱ���������ܲ������ѭ���������
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
��.H2S�����ڼ��ͳ������������ӡ�
(2)H2S�ĵ�һ�����뷽��ʽΪ________��
(3)��֪��25 ��ʱ��Ksp(SnS)��1.0��10��25��Ksp(CdS)��8.0��10��27�����¶��£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��CdCl2��SnCl2�Ļ����Һ��ͨ��H2S����Sn2����ʼ����ʱ����Һ��c(Cd2��)��________(��Һ����仯���Բ���)��
��.H2S��ú����ԭ����������̵���Ҫ�м��塣��Ӧԭ��Ϊ
��.COS(g)��H2(g) ![]() H2S(g)��CO(g)����H����7 kJ��mol��1��
H2S(g)��CO(g)����H����7 kJ��mol��1��
��.CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H����42 kJ��mol��1��
CO2(g)��H2(g)����H����42 kJ��mol��1��
(4)��֪������1 mol�����еĻ�ѧ���������յ����������ʾ��
���� | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
����/(kJ��mol��1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
����x��________��
(5)��10 L�ݻ�������ܱ������г���1 mol COS(g)��1 mol H2(g)��1 mol H2O(g)����������������Ӧ��������������ʱ����ϵ��CO��ƽ������������¶�(T)�Ĺ�ϵ��ͼ��ʾ��
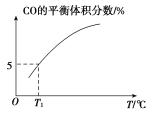
�������¶����ߣ�CO��ƽ���������_____(����������������С��)��ԭ��Ϊ_______
��T1��ʱ�����ƽ��ʱ��ϵ��COS�����ʵ���Ϊ0.80 mol������¶��£�COS��ƽ��ת����Ϊ_____����Ӧ����ƽ�ⳣ��Ϊ_____(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ��Ӧԭ���о���������������������������Ҫ�����塣
��1����֪��2SO2(g)+ O2(g)![]() 2SO3(g) ��H1
2SO3(g) ��H1
2NO(g)+ O2(g)![]() 2NO2 (g) ��H2
2NO2 (g) ��H2
NO2 (g) + SO2(g)![]() SO3(g) + NO(g) ��H3
SO3(g) + NO(g) ��H3
����H3 =__________(����H1����H2��ʾ)���������������Ӧ����ʽ��ƽ�ⳣ���ֱ�ΪK1�� K2��K3����K3 =__________(��K1��K2��ʾ)��
��2����ͼ��ʾ��A �Ǻ��ݵ��ܱ�������B ��һ������ɱ�ij������ҡ����ֺ��£��ر�K2���ֱ�2mol NO ��1 mol O2ͨ��K1��K3�ֱ����A��B �У������ķ�ӦΪ2NO(g)+ O2(g)![]() 2NO2 (g) [������2NO2 (g)
2NO2 (g) [������2NO2 (g)![]() N2 O4 (g) ]����ʼʱA��B �������ͬ��Ϊa L��
N2 O4 (g) ]����ʼʱA��B �������ͬ��Ϊa L��
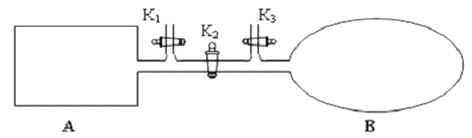
������˵����ʾ��ͼ��ȷ���Ҽ���˵��A �����з�Ӧ�ﵽƽ��״̬������˵��B �����з�Ӧ�ﵽƽ��״̬����_________��
a. A��B �������������ɫ�����ٷ����仯
b. A��B ������NO ��O2���ʵ���Ũ�ȱȾ�Ϊ2:1

�� T��ʱ��A �����з�Ӧ�ﵽƽ��ʱ��ƽ�ⳣ��Kp = 8��10��2 ��kPa)��1����A �����з�Ӧ�ﵽƽ��ʱp(NO2) = 200kPa����ƽ��ʱNO��ת����Ϊ_____________����Kp ����ƽ���ѹ����ƽ��Ũ�ȼ�������ƽ�ⳣ������ѹ����ѹ�����ʵ���������
��3����0.2 mol SO2��0.15 mol O2ͨ��2L ���ܱ������У����SO2�����ʵ�����ʱ��仯�� ͼʵ�� ��ʾ��
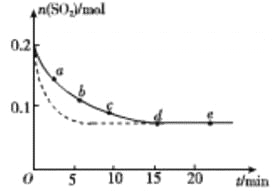
��� | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
��ab ��ƽ����Ӧ����____________��������������С����������������bc ��ƽ����Ӧ���ʣ�de ��ƽ����Ӧ����Ϊ_________________��
�����ı�ijһ��ʵ�����������SO2�����ʵ�����ʱ��仯��ͼ��������ʾ����ı��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����Ԫ�صIJ�����Ϣ���±���ʾ��
Ԫ�� | X | Y | Z | W |
��� ��Ϣ | ������Ԫ�أ�����ϼ�Ϊ+7�� | ��̬ԭ���У�����ռ�ݵ�����ܲ����ΪL������ܼ���ֻ����������������ͬ�ĵ��� | ������ӹ���15���˶�״̬ | ����X�γ����ֳ���������WX2��WX3������WX3��Һ�ܷ�����ɫ��Ӧ |
�ش��������⣺
��1��W�Ļ�̬ԭ�ӵ����Ų�ʽΪ___��X��Y��Z����Ԫ�ص縺���ɴ�С��˳��Ϊ___(�þ����Ԫ�ط�����д)��
��2��������YX4��ZX3��ZX5(��̬��Һ̬ʱ)�У�����ԭ�ӵĹ�����Ͳ���sp3�ӻ�����___ (�ѧʽ����ͬ�������ӹ����������������___��ZX3����___�����Է��ӡ��Ǽ��Է��ӣ���
��3����֪WX3���۵㣺306�棬�е㣺319�棬��WX3�ľ�������Ϊ___��
��4��Zԭ�ӵļ۵��ӹ����ʾʽΪ___��
��5��WԪ�صĵ��ʾ����ڲ�ͬ�¶��������ֶѻ���ʽ�������ֱ���ͼ��ʾ������������������Wԭ�ӵ���λ��Ϊ___����W��ԭ�Ӱ뾶Ϊrcm�������ӵ�����ΪNA��������������������ܶȿɱ�ʾΪ___gcm-3��
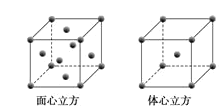
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com