
【题目】以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O2![]() 2Cu+SO2。下列说法不正确的是( )
2Cu+SO2。下列说法不正确的是( )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中既是氧化剂又是还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
【答案】C
【解析】
A.该反应Cu2S+O2 ![]() 2Cu+SO2中,硫元素化合价由-2价变为+4价,氧元素化合价由0价变为-2价,铜元素化合价由+1价变为0价,所以化合价发生变化的元素是3种,故A正确;
2Cu+SO2中,硫元素化合价由-2价变为+4价,氧元素化合价由0价变为-2价,铜元素化合价由+1价变为0价,所以化合价发生变化的元素是3种,故A正确;
B.该反应中硫元素化合价由-2价变为+4价,铜元素化合价由+1价变为0价,所以Cu2S既是氧化剂又是还原剂,故B正确;
C.铜元素化合价从+1价变化为0价,硫元素化合价从-2价变化为+4价,氧元素化合价从 0价变化为-2价,依据电子守恒得到:当1molO2参加反应时,共转移6mole-,故C错误;
D.二氧化硫被分离、回收后氧化生成SO3,三氧化硫和水反应生成硫酸,所以可以作为制取硫酸的原料,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是其他几种烃的3倍;②在适宜条件下,A、B、C都能跟氢气发生加成反应,其中A可以转化为D,B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KMnO4溶液褪色,而A、D、E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。
(1) 写出D、E的结构简式:D__________E__________。
(2) 写出A与液溴反应的化学方程式______________________________________
(3) 写出实验室制取B的化学方程式______________________________________
(4) 写出C发生加聚反应产物的结构简式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①![]() ;
;![]() ;
;
②![]() ,
,![]() ;
;
③![]() ,
,![]() ;
;
1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为________。
(2)已知![]() 的反应历程分两步:
的反应历程分两步:
①![]() (快);
(快);![]() ,
,![]() ;
;
②![]() (慢);
(慢);![]() ,
,![]()
一定温度下,反应![]() 达到平衡状态,该反应的平衡常数的表达式K=____(用
达到平衡状态,该反应的平衡常数的表达式K=____(用![]() 表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
(3)用活性炭还原法处理氮氧化物的有关反应为:![]() 。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
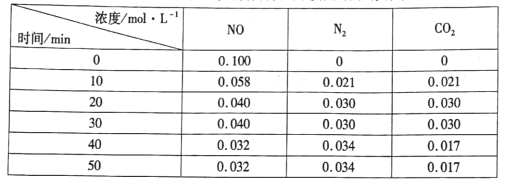
①T℃时,该反应的平衡常数的计算式为______。
②在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是____
③在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(4)反应N2O4(g) ![]() 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:![]() ,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
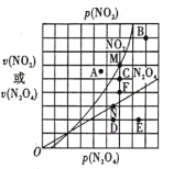
在T℃时,图中M、N点能表示该反应达到平衡状态,理由是___________ 。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在体积为5L的密闭容器中,充入1mol A气体,发生如下可逆反应:2A(g)![]() B(g)+C(?),2min后反应达到平衡,A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是
B(g)+C(?),2min后反应达到平衡,A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是
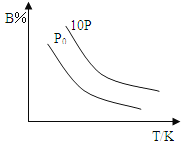
A.0~2min时间内B物质的平均反应速率为0.03mol/(L·min)
B.该反应的正反应是放热反应,且C为非气体物质
C.达到平衡后,保持温度和容器体积不变,再充入1mol A,平衡向正反应方向移动
D.若温度和容器体积不变,起始时充入B和C各0.5mol,则达到平衡时,n(A)小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法错误的是
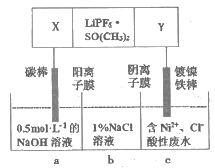
A. 电极Y应为Li
B. X极反应式为FeS+2Li++2e-=Fe+Li2S
C. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(Ni0.1Co0.9P)。回答下列问题:
(1)Co在元素周期表中的位置为_______,Co2+价层电子排布式为_______。
(2)Co、Ni可形成[Co(NH3)6]Cl2、K3[Co(NH3)6]、Ni(CO)4、[Ni(NH3)6]SO4等多种配合物。
①SO42-的空间构型为_____,NO3-中N原子的杂化轨道类型为_______。
②C、N、O、S四种元素中,第一电离能最大的是_______。
③1 mol [Co(NH3)6]Cl2中含有σ键的数目为______;已知NF3比NH3的沸点小得多,试解释原因_______。
(3)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为ρ g·cm-3,计算晶体中硼原子和磷原子的最近核间距为________cm。
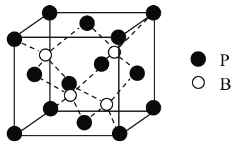
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到炭、氢气、甲烷、乙烯、丙烯、苯和甲苯。用图所示装置探究废旧塑料的再利用。下列叙述不正确的是( )
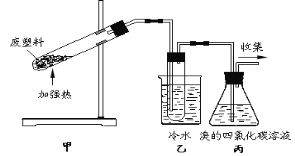
A.聚丙烯可表示为![]()
![]()
B.装置乙的试管中可收集到芳香烃
C.装置丙中可得到卤代烃
D.最后收集的气体可做燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
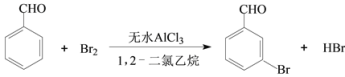
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com