
【题目】近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(Ni0.1Co0.9P)。回答下列问题:
(1)Co在元素周期表中的位置为_______,Co2+价层电子排布式为_______。
(2)Co、Ni可形成[Co(NH3)6]Cl2、K3[Co(NH3)6]、Ni(CO)4、[Ni(NH3)6]SO4等多种配合物。
①SO42-的空间构型为_____,NO3-中N原子的杂化轨道类型为_______。
②C、N、O、S四种元素中,第一电离能最大的是_______。
③1 mol [Co(NH3)6]Cl2中含有σ键的数目为______;已知NF3比NH3的沸点小得多,试解释原因_______。
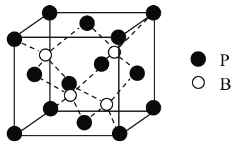
(3)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为ρ g·cm-3,计算晶体中硼原子和磷原子的最近核间距为________cm。
【答案】第四周期Ⅷ族 3d7 正四面体 sp2杂化 N 24NA NH3分子间存在氢键,作用力大 ![]() ×
×
【解析】
(1)根据钴元素的原子序数为27,利用构造原理可确定其核外电子排布,从而确定其在周期表中的位置,Co原子失去最外层2个电子得到Co2+离子,进而可确定其价层电子排布式;
(2)①根据离子的中心原子的价层电子对数确定中心原子的杂化类型以及离子的空间结构;
②根据同周期元素的第一电离能从左到右递增,同主族元素第一电离能从上到下递减,同时注意IIA、VA族的特殊性判断;
③结合粒子的组成,N-H单键和配位键都是σ键;分子晶体的熔沸点与相对分子质量有关,存在氢键的熔沸点异常高;
(3)通过晶胞的结构确定晶胞的组成,确定晶胞的质量,结合晶胞的密度,可以求出晶胞参数,晶体中硼原子和磷原子的最近核间距为晶胞体对角线的![]() ,体对角线长度为晶胞边长的
,体对角线长度为晶胞边长的![]() 倍,得出晶体中硼原子和磷原子的最近核间距。
倍,得出晶体中硼原子和磷原子的最近核间距。
(1)Co是27号元素,在周期表中处在第四周期第VIII族,其核外电子排布为[Ar]3d74s2,Co原子失去最外能层上的2个4s电子形成Co2+,则Co2+离子的价层电子排布式为3d7;
(2)①SO42-中S原子以sp3杂化轨道成键、该离子中存在4个σ键,因此SO42-离子空间构型为正四面体形;NO3-中氮原子价层电子对数为3+![]() =3,N原子轨道的杂化类型为sp2杂化;
=3,N原子轨道的杂化类型为sp2杂化;
②C、N、O、S四种元素中,C、N、O是同一周期元素,元素的第一电离能随原子序数的增大呈增大趋势,但是N原子2p轨道处于半满状态的稳定状态,失去电子消耗能量比O大,故其第一电离能大于O元素;O、S同一主族元素,同主族元素从上到下第一电离能逐渐减小,故四种元素中第一电离能最大的是N;
③[Co(NH3)6]Cl2中配位体NH3中的N-H键是σ键,Co原子与N原子之间存在配位键是σ键,1个[Co(NH3)6]Cl2中含有24个σ键,则1 mol该物质中含有24 molσ键;
NF3与NH3均为分子构成的物质,氨气分子间存在氢键导致其沸点反常的高;
(3)由图可知,1个晶胞中含有4个B原子,含有P原子数目为8×![]() +6×
+6×![]() =4个,故晶胞质量m=
=4个,故晶胞质量m=![]() g,设边长为a cm,则晶胞的体积V=a3 cm3,故晶胞密度ρ=
g,设边长为a cm,则晶胞的体积V=a3 cm3,故晶胞密度ρ=![]() gcm3,解得a=2×
gcm3,解得a=2× cm。晶体中硼原子和磷原子的最近核间距为晶胞体对角线的
cm。晶体中硼原子和磷原子的最近核间距为晶胞体对角线的![]() ,体对角线长度为晶胞边长的
,体对角线长度为晶胞边长的![]() 倍,所以晶体中硼原子和磷原子的最近核间距=
倍,所以晶体中硼原子和磷原子的最近核间距=![]() ×2×
×2× cm=
cm=![]() ×
× cm。
cm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率
B.已知反应H2O(g) +SO2(g)= H2SO3 (l),该过程熵值增大
C.同温同压下,H2(g) + Cl2(g) =2HCl(g)在光照和点燃条件下的ΔH不同
D.已知2H2O(l) =2H2(g) + O2(g) ΔH = +571.6 kJ·mol-1,则氢气燃烧热为285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
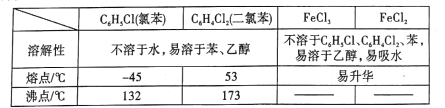
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
(1)用H2还原无水FeCl3制取FeCl2。有关装置如图1所示:
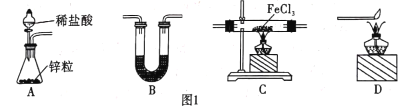
①H2还原无水FeCl3制取FeCl2的化学方程式为________ 。
②B中盛放的试剂是____,按气流由左到右的方向,上述仪器的连接顺序为 ____(填字母,装置可多次使用)。
③该制备装置的缺点为______。
(2)利用反应![]() ,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
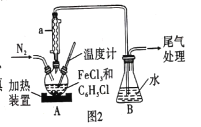
①仪器a的作用是 _______。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____(填名称),回收滤液中C6H5Cl的操作方法是____。
③在反应开始之前先通一段时间N2的目的是 ____,在反应完成后继续通一段时间N2的作用是____
④反应后将锥形瓶中溶液配成250 mL,量取25. 00 mL所配溶液,用0.40 mol·L-1 NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19. 70 mL,则氯化铁的转化率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O2![]() 2Cu+SO2。下列说法不正确的是( )
2Cu+SO2。下列说法不正确的是( )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中既是氧化剂又是还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )
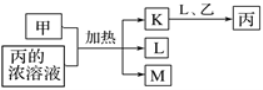
A.Y、Z、W三种元素电负性:W>Z>Y
B.Y、Z、W三种元素第一电离能:Z>W>Y
C.L的沸点一定比X、Y组成的化合物沸点高
D.由X、Y、Z、W构成的化合物中只能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
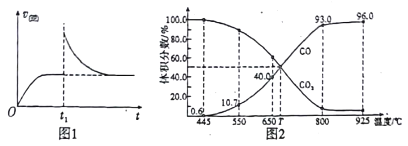
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
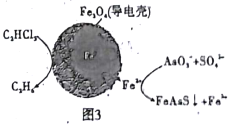
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量非常丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参加的两个反应的化学方程式: ________________。
(2)写出赤铁矿被![]() 还原成铁的化学方程式:__________________________。
还原成铁的化学方程式:__________________________。
(3)实验室中可用![]() 还原
还原![]() ,在加热
,在加热![]() 前应先_________,否则可能发生________现象;未反应完的
前应先_________,否则可能发生________现象;未反应完的![]() ___________(填“能”或“不能”)排放到大气中,应做________处理。
___________(填“能”或“不能”)排放到大气中,应做________处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图给出了8种有机化合物的转化关系,请回答下列问题:
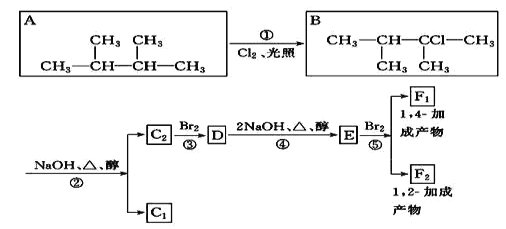
(1)根据系统命名法,化合物 A 的名称是_____。
(2)上述框图中,①是_______反应,②是_______反应,③是______反应。(填反应类型)
(3)化合物 E 是重要的工业原料,写出由 D 生成 E 的化学方程式:_____。
(4)F1的结构简式是_______,F1与F2互为____________。
(5)上述八种化合物中,属于二烯烃的是_________(写字母代号),二烯烃的通式是_________。
(6)写出D在一定条件下发生完全水解的反应方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com