
����Ŀ������˵������ȷ���ǣ� ��
A.ͬһ���淴Ӧʹ�ò�ͬ�Ĵ���ʱ����Ч����������ƽ��ת����
B.��֪��ӦH2O(g) +SO2(g)= H2SO3 (l)���ù�����ֵ����
C.ͬ��ͬѹ�£�H2(g) + Cl2(g) =2HCl(g)�ڹ��պ͵�ȼ�����µ���H��ͬ
D.��֪2H2O(l) =2H2(g) + O2(g) ��H = +571.6 kJ��mol��1��������ȼ����Ϊ285.8 kJ��mol��1
���𰸡�D
��������
Aѡ������ı仯ѧ��Ӧ���ʣ���Ӱ��ƽ���ƶ�����ƽ��ת���ʲ�����ߣ���A����
Bѡ�����Ӧ��2mol��̬���ʷ�Ӧ����1molҺ̬���ʣ���Ϊ��ֵ��С�Ĺ��̣���B����
Cѡ���Ӧ��ȡ���ڷ�Ӧ��ʼ̬����̬���뷴Ӧ���̺������أ������۷�Ӧ�ǵ�ȼ���Ǽ��ȣ���Ӱ�췴Ӧ�ȵ���ֵ����C����
Dѡ�ȼ����ָ1mol��ȼ����ȫȼ�������ȶ��Ļ�����ʱ���ų��������������Ȼ�ѧ����ʽ�ĺ��壬H2�ı�ȼ���ȵ��Ȼ�ѧ����ʽΪ��![]() O2(g) +H2(g) = H2O(l) ��H = ��285.8 kJ��mol��1����D��ȷ��
O2(g) +H2(g) = H2O(l) ��H = ��285.8 kJ��mol��1����D��ȷ��
������������ΪD��


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL 0.1mol/L��ˮ�еμ�һ��Ũ�ȵ�ϡ���ᣬ��Һ����ˮ�����������Ũ���������������ı仯��ͼ��ʾ��������˵����ȷ����(����)
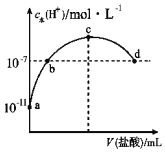
A.�����£�0.1 mol/L��ˮ�У�c (OH��)��1��10��5 mol/L
B.b�������Һ������
C.c����Һ��c(NH4+)��c(Cl��)
D.d����Һ�У�c(Cl��)��c(NH4+)��c(OH��)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ��Ԫ�ء�
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
�Իش��������⣨ע�⣺ÿ���е���ĸ����Ϊ�ϱ��е���ĸ���ţ�����ΪԪ�ط��ţ�
(1)N�ĵ��ʺ�ˮ������Ӧ�����ɹ���X����I�ĵ�����X��Ӧ�Ļ�ѧ����ʽ_______��
(2)D����̬�⻯���VSEPRģ�͵�����Ϊ_______��
(3)��A��C��D�γɵ�ACD�����У�����������������= _______________��
(4)Ҫ֤��̫�����Ƿ���R Ԫ�أ��ɲ��õķ�����__________________________��
(5)Ԫ��M�Ļ�����(ME2L2)���л��ϳ��п������������Ȼ��������������л��ﷴӦ���ش����⣺
��ME2L2������Ϊ���ɫҺ�壬����CCl4��CS2�Ȼ��ܣ��ݴ˿��ж�ME2L2��_________������ԡ��Ǽ��ԡ������ӡ�
�ڽ�N��O�ĵ����õ������Ӻ����D������������Ӧ��ˮ����Ũ��Һ�У����Ƴ�ԭ��أ�����ɸ������ϵ�Ԫ�ص���Χ���ӹ����ʾʽΪ______________________��
(6)��O2����Һ�м��백ˮ���γ���ɫ�������������백ˮ���������ܽ�����ɫ����Һ��д�������ܽ�����ӷ���ʽ_____��
(7)��F ��K����Ԫ���γɵĻ�����������ԭ�ӵļ۵���ȫ������ɼ�����û�����Ŀռ乹�͵�����Ϊ___��
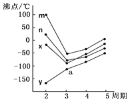
(8)��ͼ�������߷ֱ��ʾ��A�塢��A�塢��A�塢��A��Ԫ����̬�⻯��е�仯����E���⻯�����ڵ�������__����m��n��x��y����
(9)1183 K���´�N����Ļ����ṹ��Ԫ��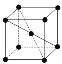 ��ʾ��1183 K����ת��Ϊ
��ʾ��1183 K����ת��Ϊ ��ʾ�ṹ�Ļ����ṹ��Ԫ����1183 K���µľ����У��ռ�������Ϊ____����1183 K���ϵľ����У���Nԭ�ӵȾ����������Nԭ����Ϊ____������ѻ���ʽ������Ϊ_____��
��ʾ�ṹ�Ļ����ṹ��Ԫ����1183 K���µľ����У��ռ�������Ϊ____����1183 K���ϵľ����У���Nԭ�ӵȾ����������Nԭ����Ϊ____������ѻ���ʽ������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E�������������������ʣ��ٸ�ȡ0��1mol�ֱ���ȼ�գ�����B��C��Eȼ�����õ�CO2��Ϊ4��48L����״������A��Dȼ�����õ�CO2����������������3�����������������£�A��B��C���ܸ����������ӳɷ�Ӧ������A����ת��ΪD��B����ת��ΪC��C����ת��ΪE����B��C����ʹ��ˮ������KMnO4��Һ��ɫ����A��D��E�����ʣ�������м������ʱ��A�����巢��ȡ����Ӧ��
(1) д��D��E�Ľṹ��ʽ��D__________E__________��
(2) д��A��Һ�巴Ӧ�Ļ�ѧ����ʽ______________________________________
(3) д��ʵ������ȡB�Ļ�ѧ����ʽ______________________________________
(4) д��C�����Ӿ۷�Ӧ����Ľṹ��ʽ_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CCuS��һ�ֶ�����̼�IJ�����������ļ��������ּ����ɽ�CO2��Դ���� ��������Ч�档CO2��������������ɵ�̼�л����Ҫ�����·�Ӧ��
��ӦI��CO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g) ��H1=��49.8kJ��mol��1
CH3OH(g)��H2O(g) ��H1=��49.8kJ��mol��1
��ӦII��CH3OCH3(g)��H2O(g) ![]() 2CH3OH(g) ��H2=��23.4kJ��mol��1
2CH3OH(g) ��H2=��23.4kJ��mol��1
��ӦIII��2CO2(g)��6H2(g) ![]() CH3OCH3(g)��3H2O(g) ��H3
CH3OCH3(g)��3H2O(g) ��H3
��1����H3=_____________kJ��mol��1
��2�����º��������£����ܱ�������ͨ�˵����ʵ�����CO2��H2��������ӦI������������˵����ӦI�ﵽƽ��״̬����_______(����ţ���
A.�����ڵĻ��������ܶȱ��ֲ���B.��Ӧ��ϵ��ѹǿ���ֲ���
C.CH3OH��CO2��Ũ��֮�ȱ��ֲ���D.����3NA��H-O��ͬʱ����2NA��C=O��
��3����ӦII��ij�¶��µ�ƽ�ⳣ��Ϊ0.25,���¶��£����ܱ������м��˵����ʵ����� CH3OCH3(g)��H2O(g)����Ӧ��ijʱ�̲�ø����Ũ�����£�
���� | CH3OCH3(g) | H2O(g) | CH3OH(g) |
Ũ��/mol��L��1 | 1.6 | 1.6 | 0.8 |
��ʱ![]() ___
___![]() ������>������<������=����������Ӧ�ﵽƽ��״̬ʱ�����������CH3OH ������� V(CH3OH)%= _____%��
������>������<������=����������Ӧ�ﵽƽ��״̬ʱ�����������CH3OH ������� V(CH3OH)%= _____%��
��4����ijѹǿ�£���ӦIII�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��T1�¶��£���6 mol CO2��12 mol H2����3 L���ܱ������У�10 min��Ӧ�ﵽƽ��״̬����0-10 min�ڵ�ƽ����Ӧ����V(CH3OCH3)=____��
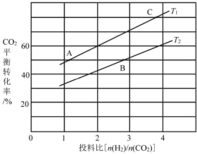
��5����ѹ�½�CO2���ϰ������1 ��3��ϣ��� ��ͬ���������·�����ӦI�ͷ�ӦIII������ͬ��ʱ�����CH3OH��ѡ���ԺͲ������¶ȵı仯����ͼ��
���У�CH3OH��ѡ����=![]() ��100%
��100%
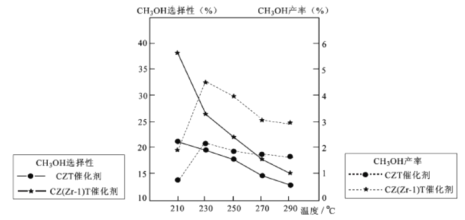
���¶ȸ���230����CH3OH�������¶����߶��½���ԭ����________��
�������������ºϳɼ״��Ĺ�ҵ������_________��
A. 230�� B. 210�� C.���� CZT D.���� CZ(Zr-1)T
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ����124gP4������P��P����ĿΪ6NA
B. �������2.24Lװ��NO2������ܱ������У����еķ�����Ϊ0.1NA
C. �������11.2L��SO3����ˮ�õ�0.5mol��H2SO4
D. �ܱ���������1molN2��3molH2����Ӧ���������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ����101kPaʱ��O2(g) +2H2(g) = 2H2O(l) ��H = ��483.6 kJ��mol��1 ��ϡ��Һ�У�OH��(aq)+ H+(aq) = 2H2O(l) ��H = ��57.3 kJ��mol��1����֪��H2��O2�������巴Ӧ����1molҺ̬ˮ������1mol��̬ˮ��ų�44kJ���������н�������ȷ���ǣ� ��
A.1mol H2��ȫȼ������Һ̬ˮ���ų�������Ϊ285.8 kJ
B.H2��O2��Ӧ����Һ̬ˮʱ���Ȼ�ѧ����ʽΪ![]() O2(g) +H2(g) = H2O(l) ��H = ��571.6 kJ��mol��1
O2(g) +H2(g) = H2O(l) ��H = ��571.6 kJ��mol��1
C.ϡ������ϡNaOH��Һ��Ӧ���к���Ϊ��57.3 kJ
D.ϡ������ϡNaOH��Һ��Ӧ����1molˮ���ų�57.3 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ú�ת��NO2��SO2��CO��NO����Ⱦ�������ǻ����������Ҫ���⡣
(1)��CH4����ԭ�������������������������Ⱦ����֪��
��![]() ��
��![]() ��
��
��![]() ��
��![]() ��
��
��![]() ��
��![]() ��
��
1 mol CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O(1)�ķ�Ӧ��Ϊ________��
(2)��֪![]() �ķ�Ӧ���̷�������
�ķ�Ӧ���̷�������
��![]() ���죩��
���죩��![]() ��
��![]() ��
��
��![]() ��������
��������![]() ��
��![]()
һ���¶��£���Ӧ![]() �ﵽƽ��״̬���÷�Ӧ��ƽ�ⳣ���ı���ʽK=____����
�ﵽƽ��״̬���÷�Ӧ��ƽ�ⳣ���ı���ʽK=____����![]() ��ʾ������Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1____E2������>����<������=������
��ʾ������Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1____E2������>����<������=������
(3)�û���̿��ԭ����������������йط�ӦΪ��![]() ��������ܱ������м���һ�����Ļ���̿��NO������(T��)ʱ�������ʵ�Ũ����ʱ��ı仯���±���
��������ܱ������м���һ�����Ļ���̿��NO������(T��)ʱ�������ʵ�Ũ����ʱ��ı仯���±���
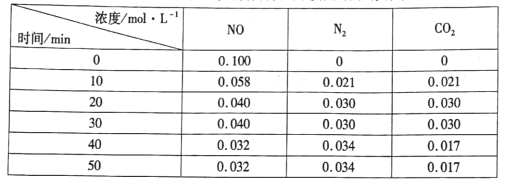
��T��ʱ���÷�Ӧ��ƽ�ⳣ���ļ���ʽΪ______��
����31 minʱ����ֻ�ı�ijһ����ʹƽ�ⷢ���ƶ���40 min��50 minʱ�����ʵ�Ũ�����ϱ���ʾ����ı��������____
����51 minʱ�������¶Ⱥ�������������ٳ���NO��N2��ʹ���ߵ�Ũ�Ⱦ�������ԭ������������ʱ��Ӧv��____v��������>������<������=������
(4)��ӦN2O4(g) ![]() 2NO2(g) ��H>0����һ��������N2O4��NO2��������������Եķ�ѹ����ѹ=��ѹ�����ʵ��������������¹�ϵ��
2NO2(g) ��H>0����һ��������N2O4��NO2��������������Եķ�ѹ����ѹ=��ѹ�����ʵ��������������¹�ϵ��![]() ������k1��k2�����¶��йصij�������Ӧ��������N2O4��NO2�ķ�ѹ��ϵ��ͼ��ʾ��
������k1��k2�����¶��йصij�������Ӧ��������N2O4��NO2�ķ�ѹ��ϵ��ͼ��ʾ��
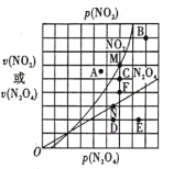
��T��ʱ��ͼ��M��N���ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬��������___________ ���ı��¶ȣ�v(NO2)����M���ΪA��B��C��v(N2O4)����N���ΪD��E��F�������ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ_______������ĸ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ�ѧ�����Ƴ��ͳɱ��ĵ����ˮ�������������������ӵ�������Ԫ����Ƭ�����(Ni0.1Co0.9P)���ش��������⣺
(1)Co��Ԫ�����ڱ��е�λ��Ϊ_______��Co2+�۲�����Ų�ʽΪ_______��
(2)Co��Ni���γ�[Co(NH3)6]Cl2��K3[Co(NH3)6]��Ni(CO)4��[Ni(NH3)6]SO4�ȶ�������
��SO42-�Ŀռ乹��Ϊ_____��NO3-��Nԭ�ӵ��ӻ��������Ϊ_______��
��C��N��O��S����Ԫ���У���һ������������_______��
��1 mol [Co(NH3)6]Cl2�к�����������ĿΪ______����֪NF3��NH3�ķе�С�ö࣬�Խ���ԭ��_______��
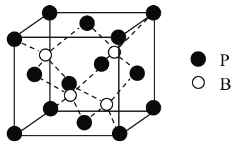
(3)������һ�ֱ��ܹ�ע����ĥͿ�ϣ��侧������ԭ���������������ܶѻ�����ԭ�������������϶��(��ͼ)����֪�������ܶ�Ϊ�� g��cm-3�����㾧������ԭ�Ӻ���ԭ�ӵ�����˼��Ϊ________cm��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com