
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124gP4中所含P—P键数目为6NA
B. 标况下,2.24L装有NO2气体的密闭容器中,含有的分子数为0.1NA
C. 标况下,11.2L的SO3溶于水得到0.5mol的H2SO4
D. 密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
【答案】A
【解析】
1molP4中P—P键数目为6mol;二氧化氮在标况下存在自发的可逆反应;三氧化硫在标况下不是气体;氮气和氢气催化反应为可逆反应。
A. 常温常压下,124gP4物质的量是1mol,含有P—P键6mol,故所含P—P键数目为6NA,A正确;
B. 标况下,2.24L NO2物质的量是0.1mol,在密闭环境下存在可逆反应2NO2![]() N2O4,含有的分子数小于0.1NA,B错误;
N2O4,含有的分子数小于0.1NA,B错误;
C. 标况下,SO3不属于气体,故仅已知体积情况下,无法计算,C错误;
D. 密闭容器中,1molN2和3molH2催化反应为可逆反应,N2+3H2![]() 2NH3,分子总数大于2NA,D错误;
2NH3,分子总数大于2NA,D错误;
答案为A。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】下列实验结果与图像相符的是( )
A.向含有盐酸、氯化镁和氯化铝的溶液中逐滴加入NaOH溶液直至过量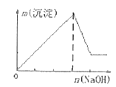
B.向澄清石灰水中通入CO2气体直至过量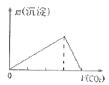
C.向NaAlO2溶液中逐滴加入盐酸直至过量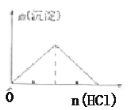
D.向AlCl3溶液中逐滴加入氨水直至过量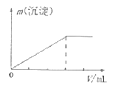
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中列出了25C、101kPa时一些物质的燃烧热数据
物质 | CH4 | C2H2 | H2 |
燃烧热/( kJ·mol-1) | 890.3 | 1299.6 | 285.8 |
已知键能:C—H键:413.4 kJ·mol-1、H—H键:436 kJ·mol-1,乙炔的结构是为H—C![]() C—H则下列叙述正确的是( )
C—H则下列叙述正确的是( )
A.2H2(g) + 2O2(g) = 2H2O(g) ΔH = -571.6 kJ·mol-1
B.CH4和C2H2中所含化学键完全相同
C.2CH4(g) = C2H2(g) + 3H2(g) ΔH = -376.4 kJ·mol-1
D.C![]() C键能为796 kJ·mol-1
C键能为796 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国和瑞典的科学家共同发现了治疗非典的新方法:吸入一氧化氮可快速改善重症非典患者的缺氧状况,缓解病情。病毒学研究同时证实,一氧化氮对非典病毒有直接抑制作用。下列有关NO的说法不正确的是()
A.NO可看作亚硝酸![]() 的酸酐
的酸酐
B.NO任意排放会造成大气污染
C.实验室制取NO气体可用排水法收集
D.氨催化氧化可生成NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率
B.已知反应H2O(g) +SO2(g)= H2SO3 (l),该过程熵值增大
C.同温同压下,H2(g) + Cl2(g) =2HCl(g)在光照和点燃条件下的ΔH不同
D.已知2H2O(l) =2H2(g) + O2(g) ΔH = +571.6 kJ·mol-1,则氢气燃烧热为285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1mol·L-1的盐酸分别滴定50mL的三种碱(AOH、BOH和DOH)溶液,滴定曲线如图所示,下列判断错误的是( )
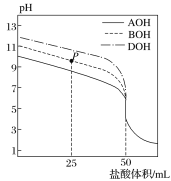
A.从反应开始至恰好完全反应,水电离出的c(H+)始终增大
B.滴定至P点时,溶液中:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+)
C.pH=7时,三种溶液中c(A+)=c(B+)=c(D+)
D.当盐酸体积为50 mL时,将三种溶液混合后:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸利多卡因(F)可用于表面麻醉,还具有抗心律失常的作用,其合成路线:

回答下列问题:
(1)A的化学名称为______________,B→C的反应类型为____________。
(2)C→D的化学方程式为___________________。
(3)E中苯环上的一氯代物有___________种。
(4)X为B的芳香族同分异构体且苯环上仅有2个取代基,红外光谱显示X有氨基(-NH2),实验测得X能与NaHCO3溶液发生反应生成CO2,则X的结构可能有______种,其中一种核磁共振氢谱峰面积比为2:2:2:2:1的X的结构简式为______________________。
(5)已知工业上可用氯气催化乙酸生产氯乙酸,再以氯乙酸为原料,以S2Cl2、Cl2为氯化剂,加入适当的催化剂,即可制得氯乙酰氯(ClCH2COCl)。请设计以CH2=CH2为主要原料合成ClCH2COCl的路线流程图________________________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
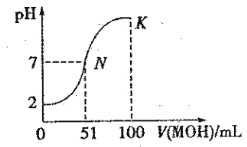
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 。
(2)常温下一定浓度的MA稀溶液的pH = a,则a_________7(填“ > ”、“< ”或“=”),用离子方程式表示其原因:_____________________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:____________________。
(4)K点对应的溶液中,c(M+) +c(MOH)__________2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =_____________mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
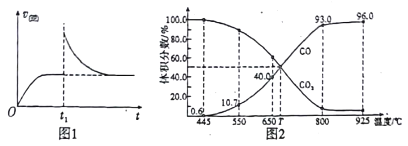
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
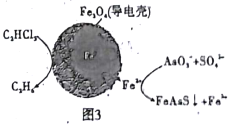
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com