
【题目】下列实验结果与图像相符的是( )
A.向含有盐酸、氯化镁和氯化铝的溶液中逐滴加入NaOH溶液直至过量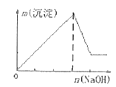
B.向澄清石灰水中通入CO2气体直至过量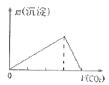
C.向NaAlO2溶液中逐滴加入盐酸直至过量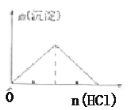
D.向AlCl3溶液中逐滴加入氨水直至过量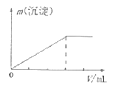
【答案】D
【解析】
A.将氢氧化钠溶液滴入某混有盐酸的氯化镁和氯化铝的混合溶液中,盐酸优先与NaOH溶液反应,所以开始时不会生成沉淀。当盐酸完全反应后,镁离子、铝离子与氢氧化钠反应生成氢氧化镁、氢氧化铝沉淀。当镁离子、铝离子完全反应后,氢氧化铝与过量的氢氧化钠溶液反应,导致沉淀部分溶解,图象中沉淀的量减少,图象变化开始不符合反应过程,A错误;
B.石灰水中通入二氧化碳,先发生![]() ,生成沉淀,后发生
,生成沉淀,后发生![]() ,故先产生沉淀,后沉淀溶解,前后两部分二氧化碳的物质的量为1:1,图象不符合,B错误;
,故先产生沉淀,后沉淀溶解,前后两部分二氧化碳的物质的量为1:1,图象不符合,B错误;
C.向![]() 溶液中逐滴加入盐酸,先产生氢氧化铝沉淀,继续滴加盐酸,
溶液中逐滴加入盐酸,先产生氢氧化铝沉淀,继续滴加盐酸,![]() 和HCl溶液反应,生成氯化铝和水,沉淀溶解,生成沉淀和沉淀溶解消耗HCl的比为1:3,图象不符合;C错误;
和HCl溶液反应,生成氯化铝和水,沉淀溶解,生成沉淀和沉淀溶解消耗HCl的比为1:3,图象不符合;C错误;
D.向![]() 溶液中加入氨水,反应生成氢氧化铝沉淀,再加氨水,沉淀不能溶解,只发生的离子反应为Al3++3NH3H2O=Al(OH)3↓+3NH4+,图象符合,D正确。
溶液中加入氨水,反应生成氢氧化铝沉淀,再加氨水,沉淀不能溶解,只发生的离子反应为Al3++3NH3H2O=Al(OH)3↓+3NH4+,图象符合,D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
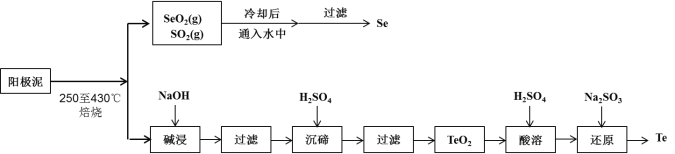
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
化学式 | 熔点/℃ | 沸点/℃ | 物理性质 |
COCl2 | -118 | 8.2 | 微溶于水,溶于芳烃、苯、四氯化碳、氯仿、乙酸等多数有机溶剂,遇水迅速水解,生成氯化氢 |
SO3 | 16.8 | 44.8 | 溶于水,并与水反应生成硫酸和放出大量的热 |
SO2Cl2 | -54.1 | 69.1 | 溶于乙酸、苯,与水反应生成H2SO4和HCl |
CCl4 | -22.9 | 76.8 | 微溶于水,易溶于多数有机溶剂 |
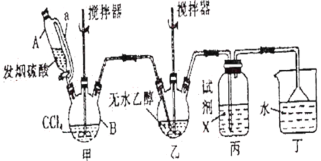
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是__________。
②仪器A的侧导管a的作用是__________。
(2)试剂X是__________,其作用是__________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是__________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:__________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是__________(三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠碱循环法可脱除烟气中的SO2.在钠碱循环中,吸收液为Na2SO3溶液,当吸收液的pH降为6左右时,可采用三室膜电解技术使其再生,图为再生示意图。下列说法正确的是( )
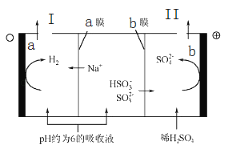
A.a极为电池的阳极
B.a极区吸收液再生的原理是HSO3﹣+H+═H2O+SO2↑
C.b电极的电极反应式是HSO3﹣﹣2e﹣+H2O═SO42﹣+3H+
D.b膜为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1mol/L氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )
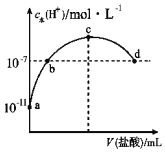
A.常温下,0.1 mol/L氨水中,c (OH﹣)=1×10﹣5 mol/L
B.b点代表溶液呈中性
C.c点溶液中c(NH4+)=c(Cl﹣)
D.d点溶液中:c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220 kJ·mol-1
试回答下列问题:
(1)H2的燃烧热为______,C3H8的燃烧热为________。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧所释放的热量为________。
(3)现有H2和C3H8的混合气体共1 mol,完全燃烧时放出的热量为769.4 kJ,则在混合气体中H2和C3H8的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新药物结构如图所示,下列有关该化合物说法正确的是
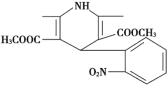
A.分子式为C17H17N2O6
B.能发生水解反应、聚合反应、取代反应、消去反应
C.分子中含有四种不同的官能团
D.能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所 测的实验数据如图所示。下列分析或推测合理的是
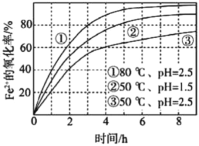
A.由①、②可知,pH越大,+2价铁越易被氧化
B.由②、③推测,若pH>7,+2价铁更难被还原
C.由①、③推测,FeCl2被O2氧化的反应为放热反应
D.60℃、pH=2.5时,4 h内Fe2+的平均消耗速率大于0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124gP4中所含P—P键数目为6NA
B. 标况下,2.24L装有NO2气体的密闭容器中,含有的分子数为0.1NA
C. 标况下,11.2L的SO3溶于水得到0.5mol的H2SO4
D. 密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com