
【题目】室温下,用0.1mol·L-1的盐酸分别滴定50mL的三种碱(AOH、BOH和DOH)溶液,滴定曲线如图所示,下列判断错误的是( )
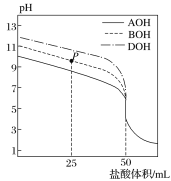
A.从反应开始至恰好完全反应,水电离出的c(H+)始终增大
B.滴定至P点时,溶液中:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+)
C.pH=7时,三种溶液中c(A+)=c(B+)=c(D+)
D.当盐酸体积为50 mL时,将三种溶液混合后:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-)
【答案】C
【解析】
A、根据图像,加入盐酸50 mL时,达到滴定终点,则三种碱液的浓度均为0.1 mol·L-1,由图中起点坐标可知三种碱均为弱碱,碱性强弱大小关系为AOH<BOH<DOH。从反应开始至恰好完全反应,不断生成可水解的盐,促进水的电离,故水电离出的c(H+)始终增大,故A正确;
B、滴定至P点时,溶质为BOH和BCl,且二者物质的量之比为1∶1,溶液呈碱性,说明BOH的电离程度大于B+的水解程度,故溶液中存在:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+),故B正确;
C、pH=7时,溶液中c(H+)=c(OH-),由电荷守恒可知,c(A+)、c(B+)、c(D+)分别与相应溶液中c(Cl-)相等,由图可知,pH=7时,c(Cl-)大小关系为A<B<D,则c(A+)<c(B+)<c(D+),故C错误;
D、当盐酸体积为50 mL时,三种溶液的溶质分别为ACl、BCl、DCl,将三种溶液混合后根据质子守恒可得c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-),故D正确;
故选C。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】以下两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220 kJ·mol-1
试回答下列问题:
(1)H2的燃烧热为______,C3H8的燃烧热为________。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧所释放的热量为________。
(3)现有H2和C3H8的混合气体共1 mol,完全燃烧时放出的热量为769.4 kJ,则在混合气体中H2和C3H8的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124gP4中所含P—P键数目为6NA
B. 标况下,2.24L装有NO2气体的密闭容器中,含有的分子数为0.1NA
C. 标况下,11.2L的SO3溶于水得到0.5mol的H2SO4
D. 密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据元素性质、相对原子质量等进行排列,预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是

A.乙元素位于现行元素周期表第四周期第ⅥA族B.原子半径:甲>乙> Si
C.乙的简单气态氢化物的稳定性弱于CH4D.推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-LiFePO4电池的电池反应为![]() ,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是
,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是
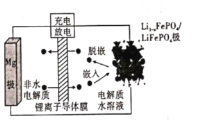
A.放电时,Li+被还原
B.放电时,电路中每流过2 mol电子,有1 mol Mg2+迁移至正极区
C.充电时,阳极上发生的电极反应为:![]()
D.充电时,导线上通过1 mol电子,左室溶液质量减轻12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素有1个2p空轨道,Y为同周期离子半径最小的金属元素;Z元素原子的最外层电子数比次外层电子数少2;M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。
请回答下列问题:
⑴M元素名称___,W元素在周期表中位置___。
⑵写出W元素基态原子的价电子排布图___,画出Y的原子结构示意图___。
⑶元素Z的最高价氧化物中,Z原子的杂化方式是___,分子的空间构型是___,属于___分子(填“极性”或“非极性”)。
⑷X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是___。
⑸Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com