
����Ŀ��2019���ǡ����ʻ�ѧԪ�����ڱ��ꡱ��1869���Ž��з�ѵ�ʱ��֪��Ԫ�ظ���Ԫ�����ʡ����ԭ�������Ƚ������У�Ԥ���˼ס�������δ֪Ԫ�ص�λ�ã���Ԥ���˶��ߵ����ԭ������������ԭʼ��¼���¡�����˵���������

A.��Ԫ��λ������Ԫ�����ڱ��������ڵڢ�A��B.ԭ�Ӱ뾶����>��> Si
C.�ҵļ���̬�⻯����ȶ�������CH4D.�Ʋ��ҵĵ��ʿ��������뵼�����
���𰸡�A
��������
��ͼ��֪��ͬһ��Ϊͬһ����Ԫ�أ���ͬһ����Ϊͬ����Ԫ�أ���Ԫ�ص����ԭ��������֪���ס��ҵ����ԭ����������AsС��Asλ�ڵ�������VA�壬��C��Si����λ�ڵ�IVA�壬��ΪGe��B��Al����λ����A�壬��ΪGa���Դ������
��ͼ��֪��ͬһ��Ϊͬһ����Ԫ�أ���ͬһ����Ϊͬ����Ԫ�أ���Ԫ�ص����ԭ��������֪���ס��ҵ����ԭ����������AsС��Asλ�ڵ�������VA�壬��C��Si����λ�ڵ�IVA�壬��ΪGe��B��Al����λ����A�壬��ΪGa��
A. ��ΪGe��λ������Ԫ�����ڱ��������ڵ�IVA�壬A�����
B. ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶����(Ga)>��(Ge)>Si��B����ȷ��
C. ̼��Geͬ�����ҵ��Ӳ����࣬�ǽ�����C>Ge����Ge�ļ���̬�⻯����ȶ�������CH4��C����ȷ��
D. ��ΪGe��λ�ڽ�����ǽ����Ľ��紦���������뵼����ϣ�D����ȷ��
��ѡA��


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ؼ��仯����Ӧ�ù㷺����ϳɰ����ʵȻ�ѧ���ϴٽ�����ʳ�����ļ�����ߡ�
(1)�ڻ�̬31Pԭ���У��������_____�������෴�ĵ��ӣ��������ռ�ݵ�����ܼ��ĵ���������ͼΪ_____�Ρ���31Pͬ���������ڵ�Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_____��
(2)Һ���д��ڵ���ƽ��2NH3![]() NH4++NH2������ϵ����������Nԭ�ӵ��ӻ���ʽΪ_____��NH2�������幹��Ϊ_____����NH4+��Ϊ�ȵ�����ķ���Ϊ_____��
NH4++NH2������ϵ����������Nԭ�ӵ��ӻ���ʽΪ_____��NH2�������幹��Ϊ_____����NH4+��Ϊ�ȵ�����ķ���Ϊ_____��
(3)���� ![]() ��ױ�
��ױ� ![]() ����Է���������������������۵�(��5.9��)���е�(184.4��)�ֱ���ڼױ����۵�(��95��)���е�(110.6��)��ԭ����_____��
����Է���������������������۵�(��5.9��)���е�(184.4��)�ֱ���ڼױ����۵�(��95��)���е�(110.6��)��ԭ����_____��
(4)�ҹ���ѧ������ʵ�������״�ȫ��������(N5��)������Co(N5)2(H2O)44H2O�ĺϳɣ���ṹ��ͼ��ʾ��Co2+����λ��Ϊ_____��N5���Ļ�ѧ������Ϊ_____��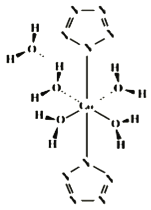
(5)���ض����ʵ���֮�ȵ�NH4Cl��HgCl2���ܷ����һ�����ʱ�����ɾ���X���侧���Ľṹͼ������������ͼ��ʾ������X���ܶ�Ϊ_____ g/cm3(�谢���ӵ�������ֵΪNA���г�����ʽ)��
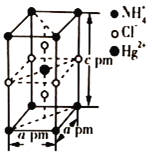
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ü������������廯�ƺ�Ũ����Ļ����ķ������Ʊ�1���嶡��ʱ��������ϩ���Ѻ���Ȳ������ɡ���Ӧ������Ӧ�����������õ�1���嶡�顣��֪�й����ʵ��������£�
�� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 |
������ | ��89.53 | 117.25 | 0.81 |
1���嶡�� | ��112.4 | 101.6 | 1.28 |
���� | 95.3 | 142 | 0.76 |
1����ϩ | ��185.3 | ��6.5 | 0.59 |
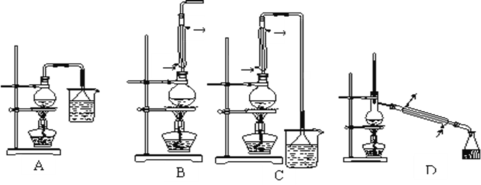
(1) ����1���嶡��ķ�Ӧװ��Ӧѡ����ͼ�е�װ��_____������ţ���
(2)���ڷ�������Ӧ�����ɶ��ѵķ�Ӧ����Ϊ_____
(3)���ڷ�������Ӧ������1����ϩ�Ļ�ѧ����ʽ_____
(4)��Ӧ��������Ӧ�������1���嶡��������Ӧѡ����ͼ�е�װ��__������ţ����ò���Ӧ���Ƶ��¶�t2��Χ��___�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20. 00 mL 0.1 mol/L H2X��Һ�е���0.1 mo1/L NaOH��Һ����Һ����ˮ�������cˮ(OH-) �ĸ�����[һlgcˮ(OH-)]��pOHˮ-������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
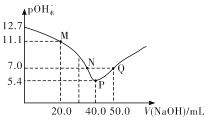
A.ˮ�ĵ���̶ȣ�M>PB.ͼ��P����Q���Ӧ��Һ��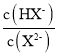 ������
������
C.N���Q����Һ��pH��ͬD.P����Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1mol��L��1������ֱ�ζ�50mL�����ּ�(AOH��BOH��DOH)��Һ���ζ�������ͼ��ʾ�������жϴ������(����)
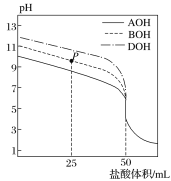
A.�ӷ�Ӧ��ʼ��ǡ����ȫ��Ӧ��ˮ�������c(H��)ʼ������
B.�ζ���P��ʱ����Һ�У�c(B��)��c(Cl��)��c(BOH)��c(OH��)��c(H��)
C.pH��7ʱ��������Һ��c(A��)��c(B��)��c(D��)
D.���������Ϊ50 mLʱ����������Һ��Ϻ�c(H��)��c(AOH)��c(BOH)��c(DOH)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������β����ȼú������������Ŀǰ���п�����Ⱦ����Ҫԭ��֮һ��NO��CO��Ϊ����β���ijɷ֣������������ڴ�ת�����з������·�Ӧ��
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) H= -a kJ��mol-1
2CO2(g)+N2(g) H= -a kJ��mol-1
(1)CO��������������֪��
��Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)��H= + 489.0 kJ/mol
��C(s)+CO2(g)=2CO(g)��H= + 172.5 kJ/mol
��CO��ԭFe2O3���Ȼ�ѧ����ʽΪ_____________________
(2)��һ���¶��£���1.2 mol NO��1.0 mol CO����ͨ�뵽�̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ�Ũ�ȱ仯��ͼ��ʾ��
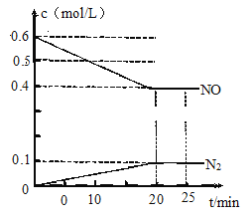
0~20 min CO2��ƽ������v(CO2)=____________��CO��ת����Ϊ____________
(3)�����ܹ�˵���÷�Ӧ�Ѿ��ﵽƽ�����__________
a.��������ѹǿ���ٸı�
b.������Ӧ���ʱ�H����
c. v(NO)=2v(N2)
d.���������ܶȲ��ٱ仯
(4)�����ַ�Ӧ��ϵ���¶Ȳ��䣬20 minʱ���������г�CO��CO2��0.2mol����ѧƽ�⽫_________(��������������������������)�ƶ������´ﵽƽ��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ_________(���������λ��Ч����)
(5)��ҵ���ð�ˮ��SO2ת��Ϊ(NH4)2SO3��������Ϊ(NH4)2SO4����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��pH=a����c(NH![]() )��c(NH3��H2O)=__________�ú�a�Ĵ���ʽ��ʾ����֪NH3��H2O�ĵ��볣��ΪKb=1.7��10-5)��
)��c(NH3��H2O)=__________�ú�a�Ĵ���ʽ��ʾ����֪NH3��H2O�ĵ��볣��ΪKb=1.7��10-5)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ��(��ѧʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ��H2B=H����HB����HB��![]() H����B2�����ش��������⡣
H����B2�����ش��������⡣
(1)Na2B��Һ��________(����������������������������)��������____________________(�����ӷ���ʽ��ʾ)��
(2)��0.1mol��L��1��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ����________(����ĸ)��
A��c(B2��)��c(HB��)��c(H2B)��0.1mol��L��1
B��c(Na��)��c(OH��)��c(H��)��c(HB��)
C��c(Na��)��c(H��)��c(OH��)��c(HB��)��2c(B2��)
D��c(Na��)��2c(B2��)��2c(HB��)
(3)��֪0.1mol��L��1NaHB��Һ��pH��2,0.1mol��L��1NaHB��Һ�и�������Ũ���ɴ�С��˳����______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ������ȵس��������������������о����������γ��������ŷŵ� CO�� NO2 ���ж������й�����������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ���� �壬�� Ӧ����ʽΪ4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)��H=-1200kJ/mol�����ڸ÷�Ӧ�� �¶Ȳ�ͬ(T2 > T1 )����������ͬʱ������ͼ����ȷ����
4CO2(g)+N2(g)��H=-1200kJ/mol�����ڸ÷�Ӧ�� �¶Ȳ�ͬ(T2 > T1 )����������ͬʱ������ͼ����ȷ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ�����жϲ���ȷ����(���� )
A.HOCH2CH2CH2OH![]()
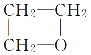 +H2O����ȥ��Ӧ
+H2O����ȥ��Ӧ
B.CH3CH2OH+CuO![]() CH3CHO+Cu+H2O�� ������Ӧ
CH3CHO+Cu+H2O�� ������Ӧ
C.H2C=CHCH=CH2+Cl2![]() CH2ClCH=CHCH2Cl���ӳɷ�Ӧ
CH2ClCH=CHCH2Cl���ӳɷ�Ӧ
D.ClCH2CH3+CH3NH2![]() CH3NHCH2CH3+HCl�� ȡ����Ӧ
CH3NHCH2CH3+HCl�� ȡ����Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com