
【题目】实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1—溴丁烷时,还会有烯、醚和溴等产物生成。反应结束后将反应混合物蒸馏,分离得到1—溴丁烷。已知有关物质的性质如下:
| 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
正丁醇 | —89.53 | 117.25 | 0.81 |
1—溴丁烷 | —112.4 | 101.6 | 1.28 |
丁醚 | 95.3 | 142 | 0.76 |
1—丁烯 | —185.3 | —6.5 | 0.59 |
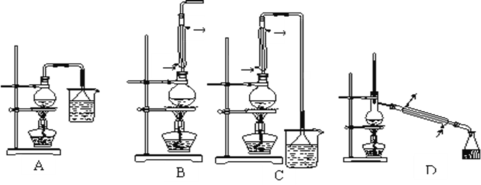
(1) 生成1—溴丁烷的反应装置应选用上图中的装置_____(填序号),
(2)由于发生副反应而生成丁醚的反应类型为_____
(3)由于发生副反应而生成1—丁烯的化学方程式_____
(4)反应结束后,将反应混合物中1—溴丁烷分离出来应选用上图中的装置__(填序号),该操作应控制的温度t2范围是___℃。
【答案】C 取代反应 CH3CH2CH2CH2OH![]() CH3CH2CH=CH2↑+H2O D 101.6- 117.25
CH3CH2CH=CH2↑+H2O D 101.6- 117.25
【解析】
由题中信息可知,将正丁醇、溴化钠和浓硫酸的混合物在控制一定温度的条件下加热回流一定的时间,可以得到1—溴丁烷粗产品,该反应过程中会有烯、醚和溴等产物生成,要注意进行尾气处理。反应结束后将反应混合物蒸馏,分离得到1—溴丁烷。
(1)用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1-溴丁烷时,会有溴、烯和醚等产物生成,正丁醇易挥发,所以需将反应物冷凝,反应生成的HBr气体易溶于水,有毒,用水或氢氧化钠溶液吸收,故选C装置;
(2)正丁醇分子间发生脱水反应生成醚,该反应属于取代反应;
(3)正丁醇在浓硫酸作催化剂加热生成正丁烯反应的化学方程式是:CH3CH2CH2CH2OH![]() CH3CH2CH=CH2↑+H2O;
CH3CH2CH=CH2↑+H2O;
(4) 1-溴丁烷和副产物互溶且沸点相差较大,所以采用蒸馏的方法将产物蒸出,选用装置D,根据所给物质的沸点,蒸馏时的温度大于产物的沸点,但不能达到副产物及其他液体组分的沸点,所以控制温度在101.6℃<t2<117.25℃。


科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中充入CO2与H2进行反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
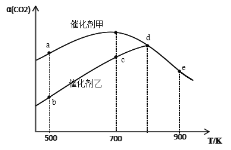
下列叙述正确的是
A. 该可逆反应的ΔH>0
B. 催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能大
C. 500K下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率高
D. d、e两点反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量不超过100的有机物A,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 A完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现A的氢谱如下:

(1)A的分子式为___________________________________;
(2)A的结构简式为:___________________________________;
(3)A是否存在顺反异构?___________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A (g)+2B (g)4C (?)+2D (?),“?”代表状态不确定。反应一段时间后达到平衡,测得生成 1.6 mol C,且反应前后压强之比为5:4,则下列说法正确的是
A.增加C,B的平衡转化率不变
B.此时B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.该反应的化学平衡常数表达式是K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某糕点的营养成分:
营养物质 | 蛋白质 | 油脂 | 淀粉 | 维生素类 | 碳酸钙 |
含量/ |
|
|
|
|
|
下列有关说法正确的是( )。
A.淀粉和纤维素属于糖类,且互为同分异构体
B.维生素是一种基本营养物质
C.淀粉、油脂、蛋白质都由碳、氢、氧三种元素组成
D.淀粉、油脂、蛋白质都为有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据元素性质、相对原子质量等进行排列,预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是

A.乙元素位于现行元素周期表第四周期第ⅥA族B.原子半径:甲>乙> Si
C.乙的简单气态氢化物的稳定性弱于CH4D.推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com