
【题目】相对分子质量不超过100的有机物A,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 A完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现A的氢谱如下:

(1)A的分子式为___________________________________;
(2)A的结构简式为:___________________________________;
(3)A是否存在顺反异构?___________(填“是”或“否”)。
【答案】C4H6O2 CH2=C(CH3)COOH 否
【解析】
有机物中氧元素的质量分数为37.21%,相对分子质量不超过100,所以分子中氧原子数目N(O)<![]() ≈2.3,有机物能与碳酸钠反应产生无色气体,说明其分子中含有-COOH,所以A中含有2个氧原子,有机物的相对分子质量为
≈2.3,有机物能与碳酸钠反应产生无色气体,说明其分子中含有-COOH,所以A中含有2个氧原子,有机物的相对分子质量为![]() =86;有机物X含有羧基,完全燃烧只生成CO2和H2O,说明有机物X由C、H、O三种元素组成。设烃基的组成为CnHm,烃基的相对分子质量为86-45=41,所以12n+m=41,若n=1,则m=29(不符合);若n=2,则m=17(不符合);若n=3,则m=5(符合);所以烃基的组成为C3H5,A为C3H5-COOH。
=86;有机物X含有羧基,完全燃烧只生成CO2和H2O,说明有机物X由C、H、O三种元素组成。设烃基的组成为CnHm,烃基的相对分子质量为86-45=41,所以12n+m=41,若n=1,则m=29(不符合);若n=2,则m=17(不符合);若n=3,则m=5(符合);所以烃基的组成为C3H5,A为C3H5-COOH。
(1)根据分析,A为C3H5-COOH,分子式为C4H6O2;
(2) 根据A的核磁共振氢谱,得到A中有三种H原子,数量比为3:2:1,其中1个H的峰为羧基,则另外一定有一个-CH3和一个-CH2-;再结合A可以使溴的四氯化碳溶液褪色,说明A中有碳碳双键;所以A的结构简式为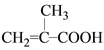 ;
;
(3)A不符合![]() ,所以不存在顺反异构。
,所以不存在顺反异构。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
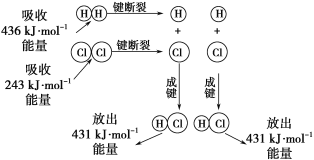
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+转化为Fe3+,下列物质可作氧化剂的是__(填字母)。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液pH至4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用___(填字母)。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH至4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就被认定为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5mol·L-1]时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素及其化合物应用广泛。如合成氨、磷肥等化学肥料促进了粮食产量的极大提高。
(1)在基态31P原子中,核外存在_____对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为_____形。与31P同周期且相邻的元素的第一电离能由大到小的顺序为_____。
(2)液氨中存在电离平衡2NH3![]() NH4++NH2﹣,体系中三种微粒中N原子的杂化方式为_____,NH2﹣的立体构型为_____,与NH4+互为等电子体的分子为_____。
NH4++NH2﹣,体系中三种微粒中N原子的杂化方式为_____,NH2﹣的立体构型为_____,与NH4+互为等电子体的分子为_____。
(3)苯胺 ![]() 与甲苯
与甲苯 ![]() 的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95℃)、沸点(110.6℃),原因是_____。
的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95℃)、沸点(110.6℃),原因是_____。
(4)我国科学工作者实现世界首次全氮阴离子(N5﹣)金属盐Co(N5)2(H2O)44H2O的合成,其结构如图所示,Co2+的配位数为_____;N5﹣的化学键类型为_____。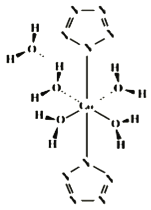
(5)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的密度为_____ g/cm3(设阿伏加德罗常数的值为NA,列出计算式)。
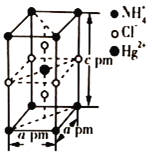
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氨溴索(又称溴环己胺醇),可用于急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病的治疗。某研究小组拟用以下流程合成盐酸氨溴索和糖精的中间体X(部分反应条件及产物已略)。

已知信息:
(Ⅰ)R1CHO+R2NH2![]() R1CH=N﹣R2
R1CH=N﹣R2
(Ⅱ)![]()
![]()
![]() (易被氧化)
(易被氧化)
请回答:
(1)流程中A名称为_____;D中含氧官能团的名称是_____。
(2)G的分子式为_____;化合物E的结构简式是_____。
(3)A→B、F→G的反应类型分别为:_____、_____。
(4)写出B+C![]() D 的化学方程式_____。
D 的化学方程式_____。
(5)化合物X同时符合下列条件的同分异构体H有_____种;其中核磁共振氢谱有5组吸收峰的结构简式为_____。
①苯环上有两个取代基,其中之一是氨基;②官能团与X相同,苯环上的一氯代物有两种。
(6)以甲苯和甲醇为有机原料,参照盐酸氨溴索的合成路线图,设计X的合成路线______(无机试剂任选,标明试剂、条件及对应物质结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体中可能含有K+、NH4+、Mg2+、Fe3+、Ba2+、Cu2+、Cl-、SO42-、HCO3-中的几种,填写下列空白:
(1)将该固体溶于水后得无色澄清溶液,由此现象得出该固体中一定不存在的离子是___;
(2)将所得无色澄清溶液进行检测,实验步骤及现象如图:

图中实验中得到的两种气体分别是___、___;白色沉淀成分是___ (填化学式);加入足量盐酸生成气体的离子方程式为___;该固体中可能存在的离子是___;
(3)通过以上检测,下列说法正确的是___
A.该固体中可能含有(NH4)2SO4、KHCO3
B.该固体中可能含有K2SO4、NH4HCO3,一定不含KCl
C.该固体中可能含有(NH4)2SO4、KCl,一定不含KHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的叙述正确的是( )
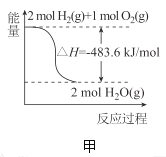
A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,则
发生反应过程中的能量变化,则![]() 的燃烧热为
的燃烧热为![]()
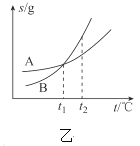
B.乙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
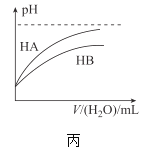
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度的NaA溶液的pH小于同浓度NaB溶液的pH
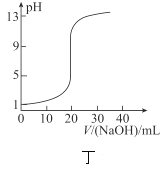
D.丁表示![]() 溶液滴定
溶液滴定![]() 醋酸溶液得到的滴定曲线
醋酸溶液得到的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1—溴丁烷时,还会有烯、醚和溴等产物生成。反应结束后将反应混合物蒸馏,分离得到1—溴丁烷。已知有关物质的性质如下:
| 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
正丁醇 | —89.53 | 117.25 | 0.81 |
1—溴丁烷 | —112.4 | 101.6 | 1.28 |
丁醚 | 95.3 | 142 | 0.76 |
1—丁烯 | —185.3 | —6.5 | 0.59 |
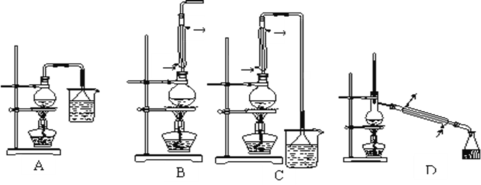
(1) 生成1—溴丁烷的反应装置应选用上图中的装置_____(填序号),
(2)由于发生副反应而生成丁醚的反应类型为_____
(3)由于发生副反应而生成1—丁烯的化学方程式_____
(4)反应结束后,将反应混合物中1—溴丁烷分离出来应选用上图中的装置__(填序号),该操作应控制的温度t2范围是___℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-![]() H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”),理由是____________________(用离子方程式表示)。
(2)在0.1mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________(填字母)。
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1mol·L-1NaHB溶液的pH=2,0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com